
【题目】关于Na2CO3与NaHCO3的性质判断正确的是
A.常温下溶解度:Na2CO3<NaHCO3
B.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
C.热稳定性:Na2CO3<NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
【答案】D
【解析】
A、常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,错误;
B、分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,错误;
C、NaHCO3不稳定,加热易分解:2NaHCO3![]() Na2CO3+CO2↑+H2O,碳酸钠受热稳定,错误;
Na2CO3+CO2↑+H2O,碳酸钠受热稳定,错误;
D、Na2CO3和Ca(OH)2混合后生成CaCO3,发生Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,NaHCO3可与澄清石灰水发生Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O或Ca(OH)2+2NaHCO3═CaCO3↓+Na2CO3+2H2O,正确;
答案选D。
【点晴】
本题考查Na2CO3和NaHCO3性质。注意把握Na2CO3和NaHCO3性质的异同,注重基础知识的积累。NaHCO3与Na2CO3相比较,NaHCO3不稳定,加热易分解,常温时,Na2CO3溶解度较大,与盐酸反应时,NaHCO3反应剧烈,都可与氢氧化钙反应生成碳酸钙沉淀,将Na2CO3和NaHCO3配成等物质的量浓度的溶液,加入酚酞试液,红色较深的是碳酸钠溶液,较浅的是碳酸氢钠溶液。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种元素在周期表中的位置如图所示,其中X的简单氢化物水溶液呈碱性。下列叙述中错误的是( )
X | Y | |
Z | W |
A.原子半径:![]()
B.Y和W的最高正价都是+6
C.元素X比元素Z的非金属性强
D.X和Y两种元素能形成多种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:

(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:

则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入![]() 一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为
一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为![]() 的
的![]() 溶液,生成的沉淀跟加入的
溶液,生成的沉淀跟加入的![]() 溶液的体积关系如图。(横坐标体积单位是
溶液的体积关系如图。(横坐标体积单位是![]() ,纵坐标质量单位是g)求:
,纵坐标质量单位是g)求:
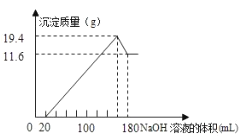
(1)合金中![]() ,
,![]() 的质量_____________
的质量_____________
(2)所用![]() 的物质的量浓度___________
的物质的量浓度___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B. 一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物,失去的电子数为0.2 NA
C. 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 金属钠着火时使用泡沫灭火器灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,也是重要的化工原料。某化学小组在实验室制备氨并完成相关性质实验。
(1)实验一:用如图所示装置制备并收集 NH3。
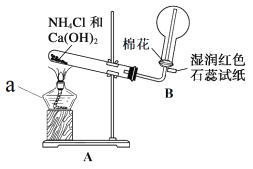
仪器 a 的名称为____________,装置 A 中产生 NH3 的化学方程式为____________, 装置 B 中用圆底烧瓶收集 NH3 的方法为____________(填“向上排空气法”或“向下 排空气法”),当湿润红色石蕊试纸颜色变为____________色,表示已经收集满 NH3。
(2)实验二:用如图所示装置进行 NH3 的喷泉实验。
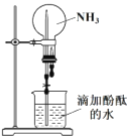
引发该喷泉实验的操作是先____________,再打开止水夹,使烧杯内的水通过导管进入烧瓶形成喷泉,说明 NH3 具有的物理性质是____________,烧瓶内溶液呈红色, 说明 NH3 的水溶液呈____________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向NaOH溶液中通入过量CO2:OH-+CO2=HCO![]()
B.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
C.电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.SO2水溶液吸收Br2蒸汽:SO2+H2O+Br2=SO![]() +2H++2Br-
+2H++2Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据提供的情境书写指定反应的方程式。
(1)工业上以碳酸锰矿(主要成分为MnCO3,另含少量FeO、Fe2O3、CaO等杂质)为主要原料生产二氧化锰的工艺流程如下:
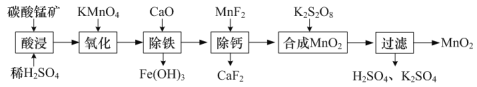
①“酸浸”时MnCO3发生反应的离子方程式为______。
②“氧化”时MnO![]() 转化为Mn2+,该反应的离子方程式为_____。
转化为Mn2+,该反应的离子方程式为_____。
③“合成MnO2”的化学方程式为______。
(2)氮氧化物是造成大气污染的重要因素。
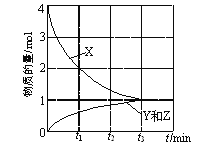
①在高压下,NO在40 ℃下分解生成两种化合物,体系中各组分的物质的量随时间变化曲线如图所示。NO分解的化学方程式为______。
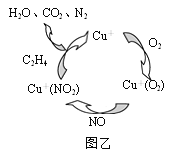
②一种以乙烯作为还原剂的脱硝(NO)机理示意图如图所示,该脱硝机理总反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:

(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com