
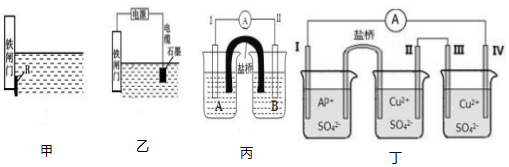
分析 (1)①铁为活泼金属,易发生电化学腐蚀,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应;
②原电池的负极金属易被腐蚀,根据原电池的工作原理来回答;
③在电解池的阴极上的金属被保护,根据电解池的工作原理来回答;
(2)①电解Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为含有亚铁离子的可溶性的盐溶液;
②B烧杯是硫酸铁溶液,溶液中铁离子在电极Ⅱ上得电子,变成亚铁离子;
(3)电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,原电池中阳离子向正极移动,据此分析解答.
解答 解:(1)①钢铁发生吸氧腐蚀时,铁作负极,发生失电子的氧化反应,即Fe=Fe2++2e-,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;
②为了降低某水库的铁闸门被腐蚀的速率,可以让金属铁做原电池的正极,其中焊接在铁闸门上的固体材料R可以是比金属铁的活泼性强的金属,
故答案为:C;
③电解池的阴极上的金属被保护,为降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的负极,
故答案为:负;
(2)①电解Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为含有亚铁离子的可溶性的盐溶液,可以是硫酸亚铁,故答案为:FeSO4;
②B烧杯是硫酸铁溶液,溶液中铁离子在电极Ⅱ上得电子,变成亚铁离子,所以Ⅱ发生的电极反应式为:Fe3++e-=Fe2+,故答案为:Fe3++e-=Fe2+;
(3)①电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极,负极上发生氧化反应,其电极反应为:Al-3e-=Al3+;I与IV相连,则Ⅳ是阴极,II为正极,Ⅲ是阳极;
故答案为:负;氧化;Al-3e-=Al3+;阳;
②原电池中阳离子向正极移动,则盐桥中的K+向II极移动;
故答案为:II.
点评 本题考查了金属的腐蚀与防护、原电池和电解池,明确原电池和电解池原理是解本题关键,知道作原电池负极和电解池阳极的金属易被腐蚀,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol I2(s)中通入2 g H2(g),反应吸热26.48 kJ | |
| B. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | |
| C. | 反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 | |
| D. | 反应(ⅰ)放出的热量多,所以产物的能量低,比反应(ⅱ)的产物更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 | |
| B. | 实验室的废酸废碱可用中和法来处理 | |
| C. | 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 | |
| D. | 金属钠着火时,可立即用沾水的毛巾覆盖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ/mol | |
| B. | 在101 kPa时,1 mol H2完全燃烧生成水蒸气,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ/mol | |
| C. | 热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol表示1个固态碳原子和1分子水蒸气反应吸热131.1kJ | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,在相同条件下,将含0.5 mol H2SO4的稀硫酸与含1 mol Ba(OH)2的水溶液混合,放出的热量可能大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏打--NaHCO3 | B. | 胆矾--CuSO4 | ||
| C. | 磁性氧化铁--Fe3O4 | D. | 生石灰--CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4LCCl4含有的分子数为NA | |
| B. | 44gCO2的体积为22.4L | |
| C. | 常温常压下,2NA个H2O分子完全电解,生成O2的体积为22.4L | |
| D. | 标准状况下,33.6LCl2含有1.5个Cl2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com