
| A. | 滴定前,未用NaOH溶液对锥形瓶进行润洗 | |
| B. | 滴定过程中,有少量盐酸滴在锥形瓶外 | |
| C. | 盛装盐酸前,未对酸式滴定管进行润洗 | |
| D. | 滴定终点时,对酸式滴定管俯视读数 |
分析 根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A.滴定前,未用NaOH溶液对锥形瓶进行润洗,标准液的体积不变,结果不变,故A错误;
B.滴定过程中,有少量盐酸滴在锥形瓶外,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故B错误;
C.盛装盐酸前,未对酸式滴定管进行润洗,标准液浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故C错误;
D.滴定终点时,对酸式滴定管俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故D正确;
故选D.
点评 本题主要考查了中和滴定操作的误差分析,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析是解答的关键,题目难度不大.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
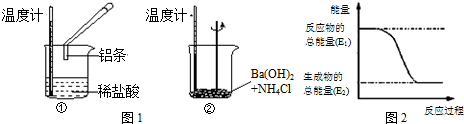
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 酸式滴定管读数时,滴定前正确读数,滴定后俯视读数 | |
| D. | 盛NaOH溶液的锥形瓶滴定前未干燥,带有水珠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
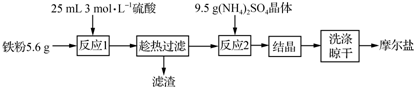
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
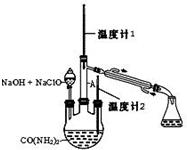 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
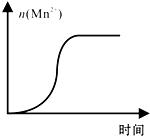 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:| KMnO4酸性溶液浓度(mol•L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol•L-1 | 体积(mL) | 浓度/mol•L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com