
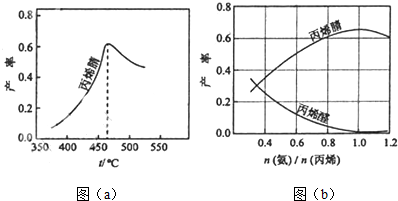
分析 (1)依据热化学方程式方向可知,两个反应均放热量大,即反应物和生成物的能量差大,因此热力学趋势大;有利于提高丙烯腈平衡产率需要改变条件使平衡正向进行,提高丙烯腈反应选择性的关键因素是催化剂;
(2)因为该反应为放热反应,平衡产率应随温度升高而降低,即低于460℃时,对应温度下的平衡转化率曲线应该是下降的,但实际曲线是上升的,因此判断低于460℃时,丙烯腈的产率不是对应温度下的平衡转化率;产率降低主要从产率的影响因素进行考虑;
(3)根据图象可知,当$\frac{{n}_{氨}}{{n}_{丙烯}}$约为1时,该比例下丙烯腈产率最高,而副产物丙烯醛产率最低,根据化学反应C3H6(g)+NH3(g)+$\frac{3}{2}$O2(g)=C3H3N(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,依据氧气在空气中约占20%计算条件比.
解答 解:(1)两个反应在热力学上趋势均很大,两个反应均放热量大,即反应物和生成物的能量差大,因此热力学趋势大;该反应为气体体积增大的放热反应,所以降低温度、降低压强有利于提高丙烯腈的平衡产率,提高丙烯腈反应选择性的关键因素是催化剂;
故答案为:两个反应均为放热量大的反应;低温、低压;催化剂;
(2)因为该反应为放热反应,平衡产率应随温度升高而降低,即低于460℃时,对应温度下的平衡转化率曲线应该是下降的,但实际曲线是上升的,因此判断低于460℃时,丙烯腈的产率不是对应温度下的平衡转化率.高于460°C时,丙烯腈产率降低,
A.催化剂在一定温度范围内活性较高,若温度过高,活性降低,故A正确;
B.由图象可知,升高温度平衡常数变小,故B错误;
C.根据题意,副产物有丙烯醛,催化剂活性降低,副反应增多,导致产率下降,故C正确;
D.反应活化能的大小不影响平衡,故D错误;
故答案为:不是;该反应为放热反应,平衡产率应随温度升高而降低;AC;
(3)根据图象可知,当$\frac{{n}_{氨}}{{n}_{丙烯}}$约为1时,该比例下丙烯腈产率最高,而副产物丙烯醛产率最低;根据化学反应C3H6(g)+NH3(g)+$\frac{3}{2}$O2(g)=C3H3N(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,而空气中氧气约占20%,所以进料氨、空气、丙烯的理论体积约为:1:7.5:1,
故答案为:1:1;该比例下丙烯腈产率最高,而副产物丙烯醛产率最低;1:7.5:1.
点评 本题考查热化学方程式,影响化学平衡的因素等知识.注意图象分析判断,定量关系的理解应用是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| B. | 1mol Cl2与足量的铝反应,转移的电子数为3NA | |
| C. | 1 mol Na 与足量O2 反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| D. | 铁和酸反应,放出标准状况下的22.4L气体,转移的电子数必为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
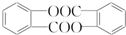 .
.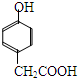 .
.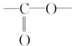 结构
结构查看答案和解析>>
科目:高中化学 来源: 题型:解答题
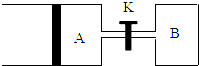 按要求填空:
按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com