
A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料。则下列推断不正确的是( )
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.五种元素中最高价氧化物对应的水化物酸性最强的是D
科目:高中化学 来源: 题型:
实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(带砝码、最小砝码为5 g)、药匙、烧杯、______、______、________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体______ g。
(3)称量。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:

②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是________________________________________________________________________
________________________________________________________________________。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了________________________________________________________________________。
(6)定容。向容量瓶中加水至液面接近刻度线________处,改用________加水,使溶液凹液面与刻度线相切。
(7)摇匀、装瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素原子序数为33,则
(1)此元素原子的电子总数是________,有________个未成对电子。
(2)有________个电子层,________个能级,________个原子轨道。
(3)它的价电子排布式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质按熔点由高到低排列的顺序正确的是( )
A.NaCl、SiO2、CO2、Na B.Na、NaCl、CO2、SiO2
C.CO2、Na、NaCl、SiO2 D.SiO2、NaCl、Na、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层。在如图甲所示的等径圆球排列中,A属于________层,配位数是________;B属于________层,配位数是________。
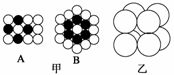
(2)将非密置层一层一层地在三维空间里堆积,得到如图乙所示的一种金属晶体的晶胞,它被称为简单立方堆积。在这种晶体中,金属原子的配位数是________,平均每个晶胞所分摊的原子数目是______。
(3)有资料表明,只有钋晶体中的原子具有图乙所示的堆积方式。钋位于元素周期表的
____________周期、____________族,元素符号是________,价电子层的电子排布式是
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于SO2的叙述中正确的是( )
A.SO2通入氯水后,溶液褪色,酸性减弱
B.是酸性氧化物,溶于水得稳定的亚硫酸
C.SO2气体通入NaOH溶液一定得到Na2SO3
D.S、SO2、SiO2三种物质均能与NaOH溶液反应,各自又能与某些酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组在实验室用铜和硫酸为原料,采用多种方法制取硫酸铜,制备方法如下:
方法一
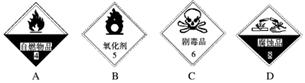
(1)浓硫酸试剂瓶上适合贴上的标签是________(填序号)。
(2)甲同学取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲同学为了验证其中灰白色沉淀的主要成分,设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:________________________________________________________。
实验结论:所得灰白色固体的化学式为__________。
(3)乙还观察到加热过程中,试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失。淡黄色固体消失的原因是(用化学方程式回答)_____________________________ _____________________________________。
直到最后反应完毕,发现试管中还有铜片剩余,乙根据自己所学的化学知识,认为试管中还有硫酸剩余。他这样认为的理由是______________________________________。
方法二
(4)丙同学认为甲设计的实验方案不好,他自己设计的思路是2Cu+O2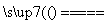 2CuO,CuO+H2SO4===CuSO4+H2O。
2CuO,CuO+H2SO4===CuSO4+H2O。
对比甲的方案,你认为丙同学的优点是
①________________________________________________________________________;
②________________________________________________________________________。
方法三
(5)丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水发现溶液逐渐呈蓝色,写出反应的化学方程式_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+ B.X+、Y3+
C.Y3+、Z2- D.X+、Z2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com