
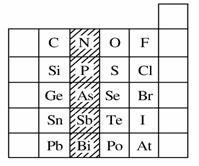
如图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是
A.N元素为第一周期元素
B.PH3的稳定性比H2S强
C.该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4
D.H3AsO4的酸性比H3PO4弱
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)  4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A.前2 min,D的平均反应速率为0.2 mol·L-1·min-1
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡不移动,化学平衡常数不变
D.增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯(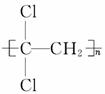 )具有超强阻隔功能,可作为保鲜食品的包
)具有超强阻隔功能,可作为保鲜食品的包
装材料。它是由______________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4—CH=CH—CH2—CH=CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是____________。
A.分子式为C18H34O2
B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应
D.能使酸性KMnO4溶液褪色
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:_________________________________________________________________。
(4)劣质奶粉中蛋白质含量很低,蛋白质水解的最终产物是______________。
(5)在淀粉中加入吊白块制得的粉丝有毒。淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作步骤、现象和结论:___________
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
I、已知CH3C18OOH在水溶液中存在以下平衡:CH3C18OOH CH3CO18OH,当 CH3C18OOH与CH3CH2OH发生酯化反应时,写出含18O的所有产物的结构简式:___
CH3CO18OH,当 CH3C18OOH与CH3CH2OH发生酯化反应时,写出含18O的所有产物的结构简式:___
__________________________________________。
II、某实验研究小组从乙醇、乙酸、乙酸乙酯的混合物中分离、回收上述三种物质,设计了以下方案:
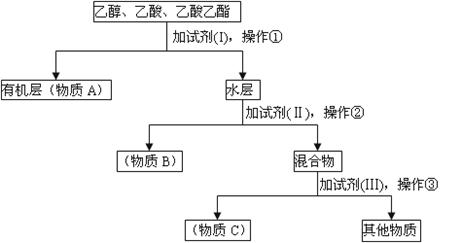
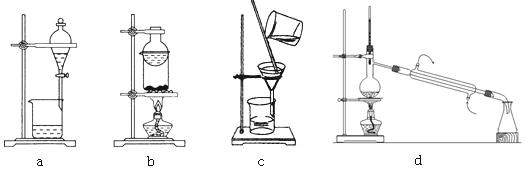
(1)实验过程中,操作①的名称是: ,操作③选用的装置是__________(填编号);
(2)A、B、C是被回收的物质,其中A所含官能团的结构简式为:_____________。A中有可能含有少量的____________(填“B”或“C”)杂质,检验是否含有此杂质,最恰当的试剂是:______________;
(3)实验中所用试剂分别是: I _ 、Ⅲ ;若不加试剂II,直接进行操作②,则在B中可能含有的杂质是:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 molH—H键断裂时吸收热量为( )
A.920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是____________,该物质中化学键类型是______________,电子式是________________________________________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为________,电子式为______________,化学键类型为________(填“离子键”、“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成________,其化学键类型为________;加热时生成________,其化学键类型为___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是__________________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO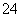 )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为163,钴的化合价为________。制备X的化学方程式为________________________;X的制备过程中温度不能过高的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C5H7Cl的有机物,其结构不可能是( )
|
| A. | 只含有1个双键的直链有机物 |
|
| B. | 含2个双键的直链有机物 |
|
| C. | 含1个双键的环状有机物 |
|
| D. | 含一个三键的直链有机物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com