
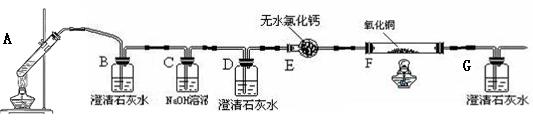
 (1)装置C的作用是 _______,装置E的作用是 。
(1)装置C的作用是 _______,装置E的作用是 。科目:高中化学 来源:不详 题型:实验题
 ______(填“偏高”、“不变”或“偏低”)。
______(填“偏高”、“不变”或“偏低”)。| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。 | 若不出现浑浊,则溶液中不存在SO32-, 若出现浑浊,则溶液中可能含有SO32-。 |
| 步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入 。 | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 器.
器.查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 实验步骤 | 预期现象和结论 |
| 步骤1:用药匙取少量固体于试管中,加入适量蒸馏水充分溶解后,将所得溶液分置于A、B试管中。 | |
| 步骤2: | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生 | 验证两者都发生了水解反应,且相互促进 |
| B | 苯酚溶液中加入几滴稀溴水没有白色沉淀出现 | 说明苯酚与溴没有发生反应 |
| C | 常温下白磷可自燃而氮气需要在放电时才与氧气反应 | 非金属性:P>N |
| D | 向相同体积、相同pH的两种一元酸中分别加入足量锌粉,测量产生氢气的体积 | 可以比较两种一元酸的酸性相对强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
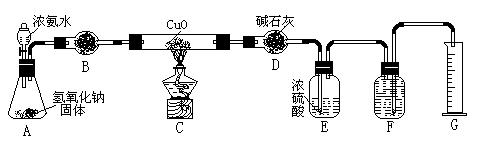
| A.碱石灰 | B.生石灰 | C.五氧化二磷 | D.氢氧化钠 |
 5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g, 则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。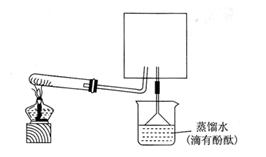
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 不同。为了验证这一事实,某同学拟用下图装置进行实验(假设实验条件为压强为101 kPa,温度为0℃)。
不同。为了验证这一事实,某同学拟用下图装置进行实验(假设实验条件为压强为101 kPa,温度为0℃)。
 g,则圆底烧瓶中发生反应的化学方程式为: 。
g,则圆底烧瓶中发生反应的化学方程式为: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 (2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是 (写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为: 。
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是 (写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为: 。 )= 。
)= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
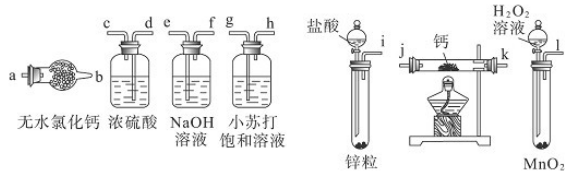
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com