
(1)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。理论上硫酸和硝酸的物质的量之比最佳为:
_________________________________。
(2)实际上,即使铜粉、硫酸及硝酸都比较纯,制得的CuSO4·5H2O中还是有可能存在的杂质是________,除去这种杂质的实验操作称为_____________________________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
请回答下列问题:已知:Ksp[Cu(OH)2]≈10- 22,Ksp[Fe(OH)2]≈10-16,Ksp[Fe(OH)3]≈10-38
22,Ksp[Fe(OH)2]≈10-16,Ksp[Fe(OH)3]≈10-38
①为了使铁元素全部沉淀,应调节pH至少为______________________________;
②甲物质可选用的是________;
A.CuCl2 B.NaOH C.Cu2(OH)2CO3 D.CuO E.H2SO4
③反应中加入少量FeSO4对铜的氧化可以起催化作用。其反应过程是:第1步,4Fe2++O2+4H+===4Fe3++2H2O,请写出其第2歩反应的离子方程式_____________________
________________________________________________________________________。
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50 ℃~60 ℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50 ℃~60 ℃,温度不宜过高的主要原因是
________________________________________________________________________;
⑤写出该反应的化学方程式为__________________________________________。
科目:高中化学 来源: 题型:
.卤代烃分子里的卤原子与活泼金属阳离子结合发生下列反应(X表示卤原子):
R—X+2Na+X—R′―→R—R′+2NaX
R—X+NaCN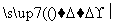 R—CN+NaX
R—CN+NaX
二烯烃可发生如下聚合反应:
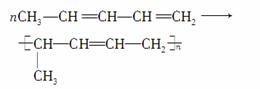
根据下列各物质的转化关系填空:
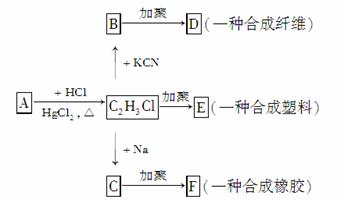
(1)A的分子式是__________,E的结构简式是________________。
(2)由B制备D的化学方程式__________________
________________________________________________________________________。
(3)由C制备F的化学方程式________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
要组装一套实验室利用液体和液体反应制备气体的装置,现设计了如下的五步操作 ,正确的程序是①将蒸馏烧瓶固定在铁架台上 ②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网 ③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集装置中 ④检查装置的气密性(利用固定装置微热的方法检查气密性) ⑤在蒸馏烧瓶中装好分液漏斗,连接好导气管
,正确的程序是①将蒸馏烧瓶固定在铁架台上 ②将酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈,放好石棉网 ③用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集装置中 ④检查装置的气密性(利用固定装置微热的方法检查气密性) ⑤在蒸馏烧瓶中装好分液漏斗,连接好导气管
A.②①⑤④③ B.④①②⑤③
C.①②⑤④③ D.①⑤④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
.奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相 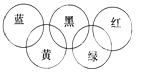
连环物质间一定条件下能发生常见反应,不相连环物质间不能发生 反应,且四种反应中必须包含化合反应、置换反应及复分解反应, 适合的一组是( )
| 蓝 | 黄 | 黑 | 绿 | 红 | |
| A | SiO2 | NaOH溶液 | CuSO4溶液 | Ag | O2 |
| B | O2 | Fe | 稀H2SO4 | NaOH溶液 | CO2 |
| C | O2 | NH3 | 稀H2SO4 | NaOH溶液 | Al(OH)3 |
| D | Mg | Al | CO2 | Fe2O3 | KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常见元素A、B、M组成的四种物质发生反应:甲+乙 丙+丁,其中甲由A和M组成,乙由B和M组成,丙只含M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为 ;生成标准状况下5.6L丙转移移电子数为 ;常温下丁溶液pH 7,用离子方程式解释 。
(2)若丁为能使品红褪色的无色气体,丙为常见紫红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。则:
①A在周期表中位置为
②将丁通至FeCl3溶液中的现象为
离子反应方程式为
③正确书写上述生成丙的化学方程式
④向MCl2的溶液中通入丁,可观察到白色的MC1沉淀,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,CO 2饱和溶液的浓度是0.03 mol·L-1,其中的CO2转变为H2CO3,而H2CO3仅有0.1%发生电离:H2CO3
2饱和溶液的浓度是0.03 mol·L-1,其中的CO2转变为H2CO3,而H2CO3仅有0.1%发生电离:H2CO3 H++HC,则溶液的pH约为( )
H++HC,则溶液的pH约为( )
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液;NaHCO3溶液与硝酸溶液
D.石灰石与硝酸;石灰石与盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com