
【题目】二硫化钨(WS2,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如下:
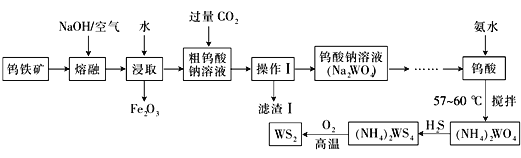
请回答下列问题:
(1)已知:W元素的原子序数是74,请写出W元素在周期表中的位置:_________________
(2)操作Ⅰ中用到的玻璃仪器有________________________________
(3)写出FeWO4在碱熔过程中发生反应的化学方程式:_________________________________
(4)滤渣Ⅰ中主要成分的形成可用离子方程式表示为:_________________________________
(5)钨丝灯管中的W在使用过程中缓慢挥发而使灯丝变细,加入碘单质可以延长使用寿命,其原理为:W(s)+2I2(g)![]() WI4(g)下列说法正确的有_______
WI4(g)下列说法正确的有_______
A. 灯管内的I2可以循环使用
B. WI4在灯丝上分解,产生的W又在灯丝上沉积
C. 温度升高时,WI4的分解速率加快,而W和I2的合成速率减慢
D. WI4在灯管壁上分解,使灯管寿命延长
(6)已知常温下,Ksp(CaWO4) =1×10-10,浓度为x mol/L的Na2WO4溶液与浓度为1×10-4 mol/L的CaCl2溶液按体积比2:1混合,产生CaWO4沉淀,则x≥___________
(7)已知生成二硫化钨的化学方程式为:2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,若生成124克WS2,则反应所转移的电子数目为________________
2WS2+4NH3+2S+2SO2+2H2O,若生成124克WS2,则反应所转移的电子数目为________________
【答案】 第六周期,ⅥB族 玻璃棒、漏斗、烧杯 4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O AlO
2Fe2O3+4Na2WO4+4H2O AlO![]() +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO![]() AB 4.5×10-6 4NA(或2.408×1024)
AB 4.5×10-6 4NA(或2.408×1024)
【解析】考查化学工艺流程,(1)W元素的原子序数为74,因此W元素位于第六周期VIB族;(2)操作I得到溶液和滤渣,此操作方法是过滤,用到的玻璃仪器是(普通)漏斗、烧杯、玻璃棒;(3)根据流程图,FeWO4在碱熔中,得到Fe2O3和Na2WO4,反应物是NaOH、FeWO4、NaOH,生成物是Na2WO4、Fe2O3,FeWO4中Fe显+3价,W显+5价,Na2WO4中W显+6价,FeWO4为还原剂,O2为氧化剂,因此根据化合价升降法,进行配平,因此化学反应方程式为:4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O;(4)根据钨铁矿含有成分中有氧化铝,氧化铝为两性氧化物,碱熔中发生Al2O3+2NaOH
2Fe2O3+4Na2WO4+4H2O;(4)根据钨铁矿含有成分中有氧化铝,氧化铝为两性氧化物,碱熔中发生Al2O3+2NaOH![]() 2NaAlO2+H2O,粗钨酸钠溶液中通入过量的CO2,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,滤渣I为氢氧化铝;(5)A、根据原理,此反应是可逆反应,因此灯管内的I2可以循环使用,故A正确;B、钨丝灯管中的W在使用过程中缓慢挥发而使灯丝变细,加入碘单质可以延长使用寿命,WI4在灯丝上分解,产生的W又在灯丝上沉积,故B正确;C、温度升高,正逆反应速率都加快,故C错误;D、根据B选项分析,故D错误;(6)根据Qc与Ksp的关系,有c(WO42-)×c(Ca2+)≥Ksp(CaWO4),代入数值,得出:
2NaAlO2+H2O,粗钨酸钠溶液中通入过量的CO2,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,滤渣I为氢氧化铝;(5)A、根据原理,此反应是可逆反应,因此灯管内的I2可以循环使用,故A正确;B、钨丝灯管中的W在使用过程中缓慢挥发而使灯丝变细,加入碘单质可以延长使用寿命,WI4在灯丝上分解,产生的W又在灯丝上沉积,故B正确;C、温度升高,正逆反应速率都加快,故C错误;D、根据B选项分析,故D错误;(6)根据Qc与Ksp的关系,有c(WO42-)×c(Ca2+)≥Ksp(CaWO4),代入数值,得出: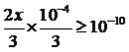 ,解得x≥4.5×10-6mol·L-1;(7)根据反应方程式,W的化合价由+6价→+4价,O2中O的化合价由0价→-2价,S的化合价由-2价→0价、+4价,生成WS2的物质的量为124/248mol=0.5mol,根据反应方程式,求出生成S的物质的量为0.5mol,SO2的物质的量为0.5mol,因此转移电子物质的量为(0.5×2+0.5×6)mol=3mol,转移电子的数目为4NA。
,解得x≥4.5×10-6mol·L-1;(7)根据反应方程式,W的化合价由+6价→+4价,O2中O的化合价由0价→-2价,S的化合价由-2价→0价、+4价,生成WS2的物质的量为124/248mol=0.5mol,根据反应方程式,求出生成S的物质的量为0.5mol,SO2的物质的量为0.5mol,因此转移电子物质的量为(0.5×2+0.5×6)mol=3mol,转移电子的数目为4NA。


科目:高中化学 来源: 题型:
【题目】物质的下列性质能肯定该物质为离子化合物的是( )
A.水溶液能导电的化合物
B.由金属元素和非金属元素组成的化合物
C.在熔化状态下能导电的化合物
D.熔点高的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法中,不利于实现让海南“天更蓝,山更绿,水更清”目标的是( )
A.污水未经处理直接排入大海B.推广使用清洁能源
C.植树进林,提高森林覆盖率D.推广使用无磷洗涤剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在反应 KMnO4+ HCl= MnCl2+ KCl+ Cl2↑+ H2O中,MnCl2为易溶于水的强电解质,回答下列问题:
①氧化剂是___________,还原剂是__________;
②配平上述方程式并用双线桥法标明电子转移的方向和数目:______________;
③写出上述反应的离子方程式:_________________________________________;
④若生成71gCl2,被氧化的HCl是_________________g。
(2)单质铁与稀HNO3可发生多种反应,当8/3n(Fe)<n(HNO3)≤4n(Fe)时,反应方程式可用下列通式表示:aFe+bHNO3(稀)=cNO十dFe(NO3)2+eFe(NO3)3十fH2O。
①假设a=16,且b、c、d、e、f均取正整数时,共有_______组系数配比。
②若a、b、c、d、e、f符合上述系数的配比关系,则b与C的关系为:b=____c。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是
A. Cu2+、NO3- 、OH- B. H+、A13+、SO42-
C. OH-、Fe2+、NO3- D. Na+、H+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种检验某气体化学性质的实验装置,图中B为开关,如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化,当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是
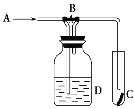
A. 浓H2SO4溶液 B. 浓NaOH溶液
C. 饱和NaCl溶液 D. 浓NaBr溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
①写出丙元素的元素符号_____________。
②写出甲、乙、丙三种元素组成的化合物在水中的电离方程式___________________。
③画出甲元素的原子结构示意图_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别表示生物体内生物大分子的部分结构模式图,据图回答:
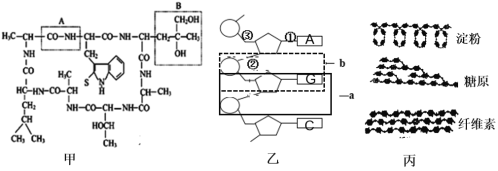
(1)从甲、乙、丙可以看出,生物大分子都是以_________为基本骨架。甲图中A结构名称为__________。
(2)乙图所示化合物的基本组成单位是_____________,各单体间通过_______(用序号表示)相连。如果该链表示RNA的一部分结构,则图示未表示出来的含氮碱基名称是___________ ;如果该链表示DNA的一部分结构,则图示未表示出来的含氮碱基名称是___________ ,图b表示的核苷酸名称为__________________________。
(3)丙图所示三种物质中,在功能上与另外两种截然不同的物质是_________,它可以参与植物细胞中__________(填某细胞结构)的构成 。丙图中三种物质的单体都是__________,该物质为还原糖,常用__________检测;而甲一般用____________检测,两种试剂使用方法的区别是前者需要__________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com