
H、C、N、O都属于自然界中常见的非金属元素。
(1)O、C、N三种元素的第一电离能最大的元素的基态原子价电子的轨道表达式(即电子排布图)为 ,p轨道按该排列的原理是 。
(2) O22+与N2互为等电子体,则O22+中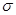 键数目和
键数目和 键数目之比为 。
键数目之比为 。
(3)N元素常形成两种含氧酸,NO2-中N原子的杂化类型是 ;NO2-的空间构型是 ,硝酸沸点不高的原因可能是 。(简答两条)
(4)Co2+在水溶液中以[Co(H2O)6]2+形式存在,向含Co2+的溶液中加入氨水,可生成[Co(NH3)6]2+,[Co(NH3)6]2+更稳定的原因是 。
(5)C、N元素形成的新材料具有如图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,则该晶体为___________晶体,若晶胞边长为acm,则该晶体的密度为 g/cm3(只需列算式,不必计算出数值,阿伏伽德罗常数的值为NA)。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年海南省高二上期中文化学试卷(解析版) 题型:选择题
下列关于材料的说法不正确的是
A.水泥是生活中常见的硅酸盐材料
B.二氧化硅是制造光导纤维的主要原料
C.不锈钢属于一种铁合金
D.纤维素是蚕丝的主要成分
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:填空题
有人设想合成具有以下结构的烃分子
(1)结构D显然是不可能合成的,原因是 。
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷。则金刚 烷的分子式为 。
烷的分子式为 。
(3)A的一种链状烃类同分异构体可由两分子乙炔聚合得到,则该链状烃的结构简式为 。
(4)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的碳碳键不是单双键交替排列的事实是 。
a.它的对位二元取代物只有一种
b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等
d.能发生取代反应和加成反应
(5)C在一定条件下可发生卤代反应,则C的六氯代物共有 种同分异构体。
(6)C的一种属于芳香烃的同分异构体是生产某种塑 料的单体,则该芳香烃分子发生加聚反应的化学方程式为: 。
料的单体,则该芳香烃分子发生加聚反应的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,则下列说法正确的是
A.标准状况下,2.24 LCCl4中含Cl原子数目为0.4NA
B.0.1mol苯乙烯中含有双键的数目为0.4NA
C.14g聚乙烯中所含原子数为3NA
D.常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上周考化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定正确的是( )
A. 原子半径:X>Y>Z>W
B. W的含氧酸的酸性比Z的含氧酸的酸性强
C. W的气态氢化物的稳定性小于Y的气态氢化物的稳定性
D. 若W与X原子序数差为5,则形成化合物的化学式为X3W2
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三12月月考化学试卷(解析版) 题型:选择题
常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如图。下列说法正确的是
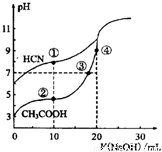
A.点①和②所示溶液中:c(CH3COO-)<c(CN-)
B.点①和②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C.点②和③所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D.点③和④所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上模拟三化学试卷(解析版) 题型:填空题
选修3——物质结构与性质
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素,相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐),A晶体的晶胞为正方体(如图1)。
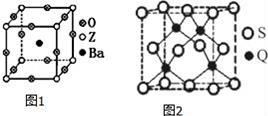
①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B,B晶体的晶胞为正方体(如图2),若晶胞棱长为5.4×10-8cm,则晶胞密度为 g•cm﹣3(列式并计算)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
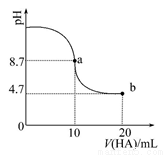
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相 同
同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二12月月考化学卷(解析版) 题型:选择题
若某溶液中有Fe2+和I-共存,要氧化I-而又不氧化Fe2+,可加入的试剂是( )
A. Cl2 B. KMnO4 C. HCl D. FeCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com