
����Ŀ������ʵ���ܴﵽ��Ӧʵ��Ŀ�ĵ���
ѡ�� | ʵ������ | ʵ��Ŀ�� |
A | ��5mL 0.005mol/L FeCl3��5mL 0.1mol/L KSCN�Ļ����Һ�У����뱥��FeCl3��Һ����Һ�ĺ�ɫ���� | ��֤Ũ�ȶԻ�ѧƽ���Ӱ�� |
B | �����£���pH��ֽ�ⶨŨ��Ϊ0.1mol��L-1 NaClO��Һ��0.1mol��L-1 CH3COONa��Һ��pH | �Ƚ�HClO��CH3COOH������ǿ�� |
C | �����£����Ũ�Ⱦ�Ϊ0.1mol/L��Һ��pH��NaA��NaB | ֤�������µ�Ka��HA��HB |
D | �������pH��Ϊ2��HA��HB������ֱ�������Zn��Ӧ��HA�ų���H2�� | ֤��HA��ǿ�� |
A. A B. B C. C D. D
���𰸡�C
��������A����ӦΪFe3++3SCN-![]() Fe(SCN)3���ټ���5�α���FeCl3��Һ��Fe3+Ũ������ƽ���������ƶ�������Һ��ɫ�������Ũ�ȶ�ƽ���ƶ���Ӱ���жϣ���A����B��NaClO��Һ����ǿ�����ԣ���������pH��ֽ�ⶨpH��Ӧ����pH�ƲⶨpH�Ƚ�����ǿ������B����C�����ԣ�HA��HB������Խ����Ӧ������ˮ��̶�Խ����Խǿ��������pH��NaA��Һ��NaB��Һ����C��ȷ��D�������pH=2��HA��HB������ֱ���������п��Ӧ��HA�ų�����࣬��HA��Ũ�ȴ�HAΪ���ᣬ��������HB��HA����D����ѡC��
Fe(SCN)3���ټ���5�α���FeCl3��Һ��Fe3+Ũ������ƽ���������ƶ�������Һ��ɫ�������Ũ�ȶ�ƽ���ƶ���Ӱ���жϣ���A����B��NaClO��Һ����ǿ�����ԣ���������pH��ֽ�ⶨpH��Ӧ����pH�ƲⶨpH�Ƚ�����ǿ������B����C�����ԣ�HA��HB������Խ����Ӧ������ˮ��̶�Խ����Խǿ��������pH��NaA��Һ��NaB��Һ����C��ȷ��D�������pH=2��HA��HB������ֱ���������п��Ӧ��HA�ų�����࣬��HA��Ũ�ȴ�HAΪ���ᣬ��������HB��HA����D����ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ʦΪ������������Ʒ�Ӧ�����������װ��������������صĿα�ʵ�飮ʵ��������ȸ���Ԥ�ȣ��������ڳ�Բ��ʱ������ͨ�����������ɼ����Ż�ȼ�գ��������������̣���������������ǣ� �� ![]()
A.���Ż�ȼ�ղ�����ɫ����
B.��Ӧ���ɵĴ����������Ȼ��ƾ���
C.���в���һ�Ž���NaOH��Һ���������������չ���������
D.���ݹ��Ҷ�������ɫ�ı仯���ж������Ƿ�Һ��ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������������������ͷ�չ����Ҫ���ʻ�����
��ˮ������õĽ������ϣ�������_________(����ĸ)��
a.�������� b.���ǽ������� c.�л��з��Ӳ���
�����й����β�Ʒ������ԭ���в���Ҫʯ��ʯ����______������ĸ����
a.�մ� b.ˮ�� c.����
�۸����������ƴ�������Ҫԭ�ϣ�����ɿ��Ա�ʾΪAl2Si2Ox(OH)y������x��y����ֵ�ֱ���______������ĸ����
a.5��4 b.6��3 c.7��2
��������Ʒ�Ĺ��ɲ�������Ҫ�Ǻϳɸ߷��Ӳ��ϵ���___������ĸ����
a.��ֽ b.��ë�� c.����Ĥ
�������������ݵ���Ҫԭ�ϣ���Ȼ����______�Y�����������������������������辭�������ı���ṹ����ǿ���е���ȡ�
��2���ٺ��ǽ���ij�������ز��������е����ʡ����ۡ�֬����ά����B1��ά����B2��ά����C�����ᡢ���ܲ��ؿƺͷḻ�ĸơ�������Ԫ�أ�����:
�����������������Ԫ�ص���________��
�����ṩ��������ҪӪ������Ϊ�����ʡ����ۺ�_______��������������ˮ��Ļ�ѧ����ʽ_____________��
��ά����C Ҳ��Ϊ_________����һ����ɫ�ľ��壬��ˮ��Һ�����ԣ���ѧ��������ʧ���ӣ�����ʹʳ���е�Fe3+ת��ΪFe2+����һ����������ά��ϵC��_____��������������������ԭ��������ˮ�����߲��и���ά����C���M��ά����C��Ԫ����____����дԪ�ط�������
��3�����õ���̬����������������������
������β��( �������ࡢCO��NOx��SO2��)�dz��п�������Ҫ��ȾԴ����������֮һ���������������ϼ�װ����ת������ʹCO��NOxת��Ϊ�����ʣ�����˵������ȷ����____��
a.CO ��NOx��Ӧ�Ļ�ѧ����ʽΪ��2xCO+2NOx===2xCO2+N2
b.�������������˿�����CO2�ĺ�����������������Ⱦ
c.���չ������£�����β����������⻯ѧ����
�ڼ�ͥװ����ʹ�õ�װ����ϻ����ͷų�������Ⱦ���һ��Ũ��ʱ��Ӱ�����彡�����������ڳ���װ����Ⱦ�����_____������ĸ����
a.NO��NO2 b.��ȩ���� c.SO2��CO
��ͨ��ˮ�ʼ��ȷ��ˮ������Ⱦ��������Ũ�Ⱥɲ�ȡ��ͬ�ķ�������ˮ���д������������ˮ��ͨ�����������________������ĸ����ȥ���к��е����ࡢ�軯�
a.�кͷ� b.������ c.������
����Ȼˮ�к���ϸС����������������������д�������������ˮ����������������ˮ��Ӧ�������������������������������д����������ˮ��Ӧ�����ӷ���ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵĵ���ƽ�⡢�����ˮ��ƽ�����������ܽ�ƽ������ڻ�ѧƽ�⣮����Ҫ��ش�����
��1������������������ˮ�����侻ˮ��ԭ�����������ӷ���ʽ��ʾ����
��2�������£�ȡ0.2molL��1 HCl��Һ��0.2molL��1 MOH��Һ�������ϣ���û����Һ���pH=5��д��MOH�ĵ��뷽��ʽ�� ��
��3��0.1mol/L��NaHA��Һ�У������Һ�е��Լ��ԣ���
�ٸ���Һ��c��H2A��c��A2���������������������=������
�����������жϵ��������������ֽ��ͣ���
��4����Cr2O72���ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10��3 molL��1��Cr2O72�� �� Ϊ��ʹ��ˮ���ŷŴ�꣬�������´����� ![]()
���̷�ΪFeSO47H2O����Ӧ��I����Cr2O72����FeSO4�����ʵ���֮��Ϊ ��
�ڳ�������������ķ�ˮ��c��Cr3+��=6.0��10��7 molL��1 �� ������ķ�ˮ��pH= �� ��Ksp[Cr��OH��3]=6.0��10��31��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ������ҵ��ɰ�ǡ���֬��Ư����ɱ�������У��������ƣ�NaClO2����������Ҫ�����ã���ͼ�������������ƵĹ�������ͼ�� 
��֪����NaClO2���ܽ�����¶����߶������ʵ������¿ɽᾧ����NaClO23H2O��
�ڳ����£�Ksp��FeS��=6.3��10��18��Ksp��CuS��=6.3��10��36��Ksp��PbS��=8��10��28
�ۢ�װ���е����������Һ����������������ͬʱ�������ᣬ��������������ͬʱ�����������ƣ�
��1��I�з�����Ӧ�����ӷ���ʽΪ ��
��2������Һ�еõ�NaClO23H2O����������������������д��ţ���
a������ b������Ũ�� c������ d����ȴ�ᾧ e������
��3��ӡȾ��ҵ�����������ƣ�NaClO2��Ư��֯�Ư��֯��ʱ���������õ���HClO2 �� ����25��ʱHClO2�����ֳ�������ĵ���ƽ�ⳣ����
���� | HClO2 | HF | H2CO3 | H2S |
Ka/molL��1 | 1��10��2 | 6.3��10��4 | K1=4.30��10��7 | K1=9.1��10��8 |
�ٳ����£����ʵ���Ũ����ȵ�NaClO2��NaF��NaHCO3��Na2S������Һ��pH�ɴ�С��˳��Ϊ���û�ѧʽ��ʾ����
��Na2S�dz��õij�������ij��ҵ��ˮ�к��е�Ũ�ȵ�Cu2+��Fe2+��Pb2+���ӣ��μ�Na2S��Һ�����������ij������������£������һ�����ӳ�����ȫʱ��������Ũ��Ϊ10��5molL��1����ʱ��ϵ�е�S2����Ũ��Ϊ ��
��4����װ��������������a�����Ϊ1.12L����״��������ת�Ƶ��ӵ����ʵ���Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ�У���������һ���ܹ�����������ǣ� ��
A.��ʹ�㷺pH��ֽ����ɫ����Һ��K+��Ba2+��Cl����Br��
B.������ ![]() =12����Һ��Fe2+��Mg2+��NO3����Cl��
=12����Һ��Fe2+��Mg2+��NO3����Cl��
C.���д���Al3+����Һ�У�Na+��Cl����AlO2����OH��
D.��ʹ���۵⻯����ֽ����ɫ����Һ��K+��SO42����S2����SO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֤���Ҵ���������һ����ԭ�����������ԭ�Ӳ�ͬ�ķ�����(����)
A.1 mol�Ҵ�ȼ������3 molˮ
B.1 mol�Ҵ���������1 mol��ȩ
C.1 mol�Ҵ��������Ľ��������õ�0.5 mol����
D.�Ҵ��ķ���ʽΪC2H6O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������£����й���pH=3��CH3COOH��Һ��pH=3��HCl��Һ�������в���ȷ����
A. ������Һ�����ʵ����ʵ���Ũ�ȣ�CH3COOH��HCl
B. ��CH3COOH��Һ��ͨ��HCl(g)�� 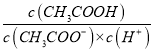 ��ֵ����
��ֵ����
C. ����pH=11�İ�ˮ��ϣ�ʹ��Һ�����ԣ�����Һ�ĵ�������ͬ��ˮ�ĵ���̶�Ҳ��ͬ
D. ��CH3COONa��Һ�зֱ�������������������Һ����Һ�е�c(Na+)/c(CH3COO-)ǰ��С����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϲ��뺣�����ƣ���һ�ָ��������ĺ���ֲ���Ʒ�ϲ��ᱡ�ɴࡢ�Ⱥ������ױ����ճɻ�ʵ��������ϲ�����ȡ���������ͼ1�� 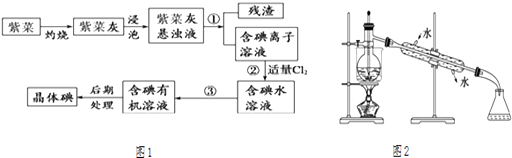
��1��ʵ���ұ����ϲˣ���Ҫ���������е�������ţ���
a���Թ� b���ձ� c������ d�������� e�������ż� f���ƾ���
��2��ָ����ȡ��Ĺ������йص�ʵ��������ƣ��� �� �� ��
��3����ȡ��Ĺ����У���ѡ����л��Լ���
A���ƾ� B���� C������ D��ʳ��ˮ
ѡ����Լ��������� ��
��4��Ϊʹ�ϲ˻��е�����ת��Ϊ����л���Һ��ʵ�������ձ���������������ƿ���ƾ��ơ����ܡ�Բ����ƿ��ʯ�����Լ���Ҫ�ļг���������Ʒ����ȱ�ٵIJ����������� ��
��5���Ӻ�����л���Һ����ȡ��ͻ����л��ܼ������뾭�����۲�ͼ2�е�ʵ��װ��ͼ�������еĴ���֮����
���������� ��
��6�����������������ʱ��ʹ��ˮԡ���ȣ����̬������ۼ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com