
下列共价化合物中,共价键的键能最大的是( )
|
| A. | HCl | B. | HF | C. | HBr | D. | HI |
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:(以下均假设反应过程中溶液体积不变).
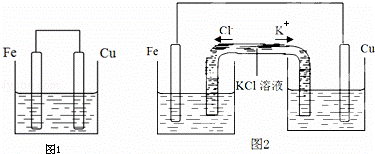
(1)铁片上的电极反应式为 .
(2)铜片周围溶液会出现 的现象.
(3)若2min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为 mol;
②该段时间内用硫酸铜表示的平均反应速率为 mol•L﹣1•min﹣1
(4)若一段时间后测得铁片减少了2.4g,同时铜片增加了3.2g,计算这段时间内该装置消耗的化学能转化为电能的百分比为 .
(5)若将该装置改为如图2所示的装置也能达到和原装置相同的作用.其中KCl溶液起沟通两边溶液形成闭合回路的作用,同时又能阻止反应物直接接触.则硫酸铜溶液应该注入 (填“左侧”、“右侧”或“两侧”)烧杯中.
查看答案和解析>>
科目:高中化学 来源: 题型:
为除去括号内的杂质,所选用的试剂或方法不正确的是
( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入足量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
2000K时,反应CO(g)+ O2(g)⇌CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)⇌2CO(g)+O2(g)的平衡常数K′为( )
O2(g)⇌CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)⇌2CO(g)+O2(g)的平衡常数K′为( )
|
| A. |
| B. | K2 | C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为 ;
(2)反应是 反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(CH2)=c(CO)•c(H2O),试判断此时的温度为 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
|
| A. | SO2和SiO2 | B. | NaCl和HCl | C. | CCl4和KCl | D. | CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的沸点逐渐升高的是( )
|
| A. | NH3 PH3 AsH3 SbH3 | B. | Si SiC H2O CO2 |
|
| C. | NaI NaBr NaCl NaF | D. | Li Na K Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 1molO的质量是16g/mol |
|
| B. | 2g H2的物质的量是 1 |
|
| C. | CO2的相对分子质量为44,1 molCO2的质量为44 g/mol |
|
| D. | NaCl的摩尔质量是58.5g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
|
| A. | CO(g)+ |
|
| B. | C(s)+ |
|
| C. | H2(g)+ |
|
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=﹣11036 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com