
【题目】某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.
I.结晶水的测定:称取7.84g浅蓝绿晶体,加热至100℃失去结晶水,冷却至室温
后,称重,质量为5.68g.
Ⅱ.NH4+的测定:将上述5.68g固体置于如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入氮气,用40.00mL l molL﹣1的硫酸溶液吸收产生氨气.蒸氨结束后取下接收瓶,用2molL﹣1NaOH标准溶液滴定过剩的硫酸,到终点时消耗20.00mLNaOH溶液.
Ⅲ.铁元素的测定:将上述实验结束后三颈瓶中的溶液全部倒入锥形瓶中,向其中加入适量3%H2O2的溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后;测得其质量为1.6g. 回答下列问题:
(1)在实验I中,不可能用到的实验仪器是(填正确答案标号).
A.烧杯
B.铁架台(带铁圈)
C.坩埚
D.蒸发皿
E.酒精灯
F.干燥器
G.托盘天平
(2)在实验Ⅱ中,通入氮气的目的是 . 蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是
(3)在实验Ⅱ中,用NaOH标准溶液滴定过剩的硫酸时,应使用式滴定管;可使用的指示剂为 .
(4)在实验中,检验沉淀是否洗净的方法是 .
(5)根据上述实验数据计算,该浅蓝绿晶体的化学式为 . 三颈瓶中发生反应的离子方程式为 .
【答案】
(1)AD
(2)将溶液中的氨全部蒸出;用蒸馏水冲洗冷凝管装置2﹣3次,洗涤液并入锥形瓶中
(3)碱;酚酞(或甲基红)
(4)取最后一次洗涤液于试管中,滴入1﹣2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净
(5)FeSO4?(NH4)2SO4?6H2O或(NH4)2Fe(SO4)2?6H2O;2NH4++Fe2++4OH﹣=Fe(OH)2↓+2NH3↑+2H2O
【解析】解:(1)结晶水的测定:称量需要托盘天平(G),加热需要酒精灯(E)、坩埚(C)、铁架台带铁圈(B)、玻璃棒、干燥时需干燥器(F)等,无须用烧杯(A)、蒸发皿(D),所以答案是:AD;(2)实验Ⅱ的目的是测定铵根离子的含量,通过铵根离子和碱反应生成的氨气的量测定,NH4++OH﹣ ![]() NH3↑+H2O,根据将氨气全部赶出,减小误差需通入氮气,蒸氨结束后用蒸馏水冲洗冷凝管装置2﹣3次,洗涤液并入锥形瓶中,目的保证生成的氨气全部进入锥形瓶中与硫酸反应,
NH3↑+H2O,根据将氨气全部赶出,减小误差需通入氮气,蒸氨结束后用蒸馏水冲洗冷凝管装置2﹣3次,洗涤液并入锥形瓶中,目的保证生成的氨气全部进入锥形瓶中与硫酸反应,
所以答案是:将溶液中的氨全部蒸出;用蒸馏水冲洗冷凝管装置2﹣3次,洗,涤液并入锥形瓶中;(3)碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中,所以用NaOH标准溶液确定过剩的H2SO4时,应使用碱式滴定管盛放NaOH溶液;NaOH溶液和硫酸溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂,甲基红为酸性变色指示剂、酚酞为碱性变色指示剂,所以可以选取甲基红或酚酞作指示剂,
所以答案是:碱;酚酞(或甲基红);(4)溶液中存在硫酸铵,若未洗净,加入1﹣2滴稀硝酸,再滴入硝酸钡溶液,有白色沉淀生成,所以检验沉淀是否洗净的方法是:取最后一次洗涤液于试管中,滴入1﹣2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净,
所以答案是:取最后一次洗涤液于试管中,滴入1﹣2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净;(5)由题给数据可知7.84g摩尔盐中m(H2O)=7.84g﹣5.68g=2.16g,n(H2O)= ![]() =0.12mol,
=0.12mol,
消耗氢氧化钠的物质的量是n=cv=lmolL﹣1×40.00mL=0.04mol,则根据反应式2NaOH+H2SO4=Na2SO4+2H2O可知:剩余硫酸的物质的量是2molL﹣1×20.00mL× ![]() =0.02mol,则根据反应式2NH3+H2SO4=(NH4)2SO4可知:与氨气反应的硫酸的物质的量是0.04mol﹣0.02mol=0.02mol,则与硫酸反应的氨气的物质的量是0.02mol×2=0.04mol,生成的m(NH3)=0.68g,2Fe2++H2O2+2H+=2Fe3++2H2O,测得其质量为1.6g为氧化铁,m(Fe2O3)=1.6g,n(Fe2O3)=
=0.02mol,则根据反应式2NH3+H2SO4=(NH4)2SO4可知:与氨气反应的硫酸的物质的量是0.04mol﹣0.02mol=0.02mol,则与硫酸反应的氨气的物质的量是0.02mol×2=0.04mol,生成的m(NH3)=0.68g,2Fe2++H2O2+2H+=2Fe3++2H2O,测得其质量为1.6g为氧化铁,m(Fe2O3)=1.6g,n(Fe2O3)= ![]() =0.01mol,则m(NH4+)=0.04mol×18g/mol=0.72g,m(Fe2+)=0.02mol×56g/mol=1.12g,则m(SO42﹣)=7.84g﹣2.16g﹣0.72g﹣1.12g=3.84g,n(SO42﹣)=
=0.01mol,则m(NH4+)=0.04mol×18g/mol=0.72g,m(Fe2+)=0.02mol×56g/mol=1.12g,则m(SO42﹣)=7.84g﹣2.16g﹣0.72g﹣1.12g=3.84g,n(SO42﹣)= ![]() =0.04mol,所以n(NH4+):n(Fe2+):n((SO42﹣):n(H2O)=0.04mol:0.02mol:0.04mol:0.12mol=2:1:2:6,该浅蓝绿晶体的化学式为FeSO4(NH4)2 SO46H2O 或(NH4)2Fe(SO4)26H2O,三颈瓶中亚铁离子和铵根离子和氢氧根反应生成氢氧化亚铁,反应为:2NH4++Fe2++4OH﹣=Fe(OH)2↓+2NH3↑+2H2O,
=0.04mol,所以n(NH4+):n(Fe2+):n((SO42﹣):n(H2O)=0.04mol:0.02mol:0.04mol:0.12mol=2:1:2:6,该浅蓝绿晶体的化学式为FeSO4(NH4)2 SO46H2O 或(NH4)2Fe(SO4)26H2O,三颈瓶中亚铁离子和铵根离子和氢氧根反应生成氢氧化亚铁,反应为:2NH4++Fe2++4OH﹣=Fe(OH)2↓+2NH3↑+2H2O,
所以答案是:FeSO4(NH4)2 SO46H2O 或(NH4)2Fe(SO4)26H2O;2NH4++Fe2++4OH﹣=Fe(OH)2↓+2NH3↑+2H2O.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】已知: 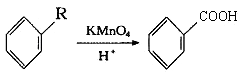 从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.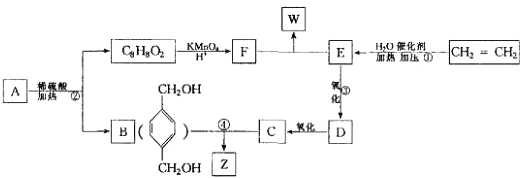
回答下列问题:
(1)写出反应类型:① , ② .
(2)写出化学反应方程式: ③
④
(3)与B互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为 ![]() , ,
, ,
(4)A的结构简式可能为(只写一种即可) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( ) 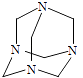
A.1:1
B.2:3
C.3:2
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( ) 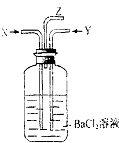
A.洗气瓶中产生的沉淀是BaCO3
B.在Z导管出来的气体中无CO2
C.洗气瓶中产生的沉淀是BaSO3
D.在Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:
(1)3g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下转化过程不可以通过化合反应一步实现的是
A. Fe→FeC13B. Fe→FeC12C. Fe2O3 → Fe(OH)3D. Fe(OH)2 → Fe(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com