
| A. | 不管什么反应使用催化剂,都可以加快反应速率 | |
| B. | 可逆反应A(g)?B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大 | |
| C. | 对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大 | |
| D. | 参加反应的物质的性质是决定化学反应速率的主要因素 |
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 7.8 g Na2S和Na2O2中含有的阴离子数大于0.1NA | |
| C. | 56 g铁片投入足量浓硫酸中生成NA个SO2分子 | |
| D. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
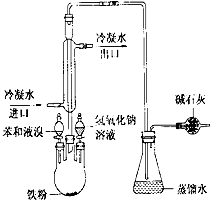 如图是实验室制取溴苯的装置图
如图是实验室制取溴苯的装置图查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | 2CH2CH2OH$→_{△}^{Cu}$2CH3CHO+H2O | ||
| C. | CH4+Cl2$\stackrel{光}{→}$CH2Cl+HCl | D. | CH2═CH2+H2$\stackrel{催化剂}{→}$CH3-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组,拟探究和比较SO2和 Cl2的漂白性,设计如图所示的实验装置二套.请你参与探究并回答下列问题.
某化学兴趣小组,拟探究和比较SO2和 Cl2的漂白性,设计如图所示的实验装置二套.请你参与探究并回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com