
 ��
������ A��B��C��D��E��FΪ1��18��Ԫ���е�һ�֣���ԭ��������������A��ԭ�Ӱ뾶��С����AΪHԪ�أ�Cԭ�ӵ�L���������K���4����C��L�㺬��6�����ӣ�ΪOԪ�أ�A��B��ԭ������֮�͵���C��ԭ����������B��ԭ������Ϊ8-1=7��ΪNԪ�أ�Fԭ�ӵ��������������������������$\frac{3}{4}$����FΪ������Ԫ�أ���F�Ĵ���㺬��8�����ӣ�����㺬��6�����ӣ�ΪSԪ�أ�D��E��F����Ԫ������������Ӧ��ˮ����֮���������ܷ�Ӧ������ԭ�������ĵ�����֮��Ϊ10����EΪAlԪ�أ�F����㺬��6�����ӣ���D����������Ϊ��10-6-3=1����DΪNaԪ�أ��ݴ˽��н��
��� �⣺A��B��C��D��E��FΪ1��18��Ԫ���е�һ�֣���ԭ��������������A��ԭ�Ӱ뾶��С����AΪHԪ�أ�Cԭ�ӵ�L���������K���4����C��L�㺬��6�����ӣ�ΪOԪ�أ�A��B��ԭ������֮�͵���C��ԭ����������B��ԭ������Ϊ8-1=7��ΪNԪ�أ�Fԭ�ӵ��������������������������$\frac{3}{4}$����FΪ������Ԫ�أ���F�Ĵ���㺬��8�����ӣ�����㺬��6�����ӣ�ΪSԪ�أ�D��E��F����Ԫ������������Ӧ��ˮ����֮���������ܷ�Ӧ������ԭ�������ĵ�����֮��Ϊ10����EΪAlԪ�أ�F����㺬��6�����ӣ���D����������Ϊ��10-6-3=1����DΪNaԪ�أ�
��1�����ݷ�����֪��BΪ��Ԫ�ء�CΪ��Ԫ�ء�DΪ��Ԫ�ء�EΪ��Ԫ�أ�
�ʴ�Ϊ�����������ƣ�����
��2��WΪAl�������ӵĺ˵����Ϊ13�������������Ϊ10�������ﵽ8�����ȶ��ṹ�������ӽṹʾ��ͼΪ�� ��
��
�ʴ�Ϊ�� ��
��
��3��A��C�ֱ�ΪH��OԪ�أ����߿����γ�ˮ��˫��ˮ������ʽ�ֱ�Ϊ��H2O��H2O2��
�ʴ�Ϊ��H2O��H2O2��
��4��BΪNԪ�أ�������������Ӧ��ˮ����Ϊ���ᣬ��������̬�⻯�ﻯ������һ���Σ��������軯��Ϊ��������Ӧ�Ļ�ѧ����ʽΪ��HNO3+NH3=NH4NO3��
�ʴ�Ϊ��HNO3+NH3=NH4NO3��
��5��Ԫ��C�ĵ���Ϊ������Ԫ��F���⻯��Ϊ���⣬���߷����û���Ӧ��������ɫ��S���ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ��O2+2H2S=2H2O+2S����
�ʴ�Ϊ��O2+2H2S=2H2O+2S����
���� ���⿼����λ�á��ṹ�����ʵ����ϵ��Ӧ�ã���Ŀ�Ѷ��еȣ����������Ϣ��ȷ�ƶϸ�Ԫ��Ϊ���ؼ���ע�����ճ�����ѧ�������дԭ����������������ѧ���ķ������������Ӧ��������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
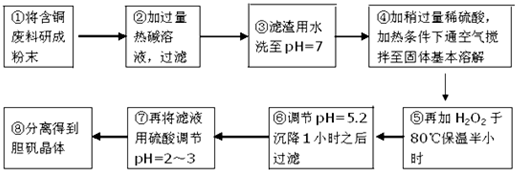
| ������ | Al��OH��3 | Fe��OH��3 | Cu��OH��2 | Mg��OH��2 | Fe��OH��2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2S��������Ũ������и��Ũ�������ˮ�ԣ� | |
| B�� | ͭ��Ũ�����Ʊ�NO2���壨Ũ�����ǿ�����ԡ����ԣ� | |
| C�� | SO2��ˮ��Һ�ܹ�ʹƷ����Һ��ɫ��H2SO3��ǿ�����ԣ� | |
| D�� | �ɿڿ���ƿ�Ǵ��д��������ݳ���H2CO3�Ļӷ��ԣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ӧ�ٶ� vA=2mol/��L•min���淴Ӧ�ٶ�vB=2 mol/��L•min�� | |
| B�� | ����Ӧ�ٶ� vA=2mol/��L•min���淴Ӧ�ٶ�vC=2 mol/��L•min�� | |
| C�� | ����Ӧ�ٶ� vA=1mol/��L•min���淴Ӧ�ٶ�vB=1.5 mol/��L•min�� | |
| D�� | ����Ӧ�ٶ� vA=1mol/��L•min���淴Ӧ�ٶ�vC=1.5mol/��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

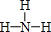 ���ڵļ���̬�⻯��ĵ���ʽΪ
���ڵļ���̬�⻯��ĵ���ʽΪ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KCl | B�� | PCl3 | C�� | NH3•H2O | D�� | Na2O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
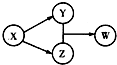 X��Y��Z��W�������ʵ�ת����ϵ��ͼ��ʾ�����ַ�Ӧ����������ԣ�����������в����ϸù�ϵ���ǣ�������
X��Y��Z��W�������ʵ�ת����ϵ��ͼ��ʾ�����ַ�Ӧ����������ԣ�����������в����ϸù�ϵ���ǣ�������| A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | Al |
| Y | FeCl2 | NaOH | CO2 | Na[Al��OH��4] |
| Z | Cl2 | Na2CO3 | CaCO3 | AlCl3 |
| W | FeCl3 | NaHCO3 | Ca��HCO3��2 | Al��OH��3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
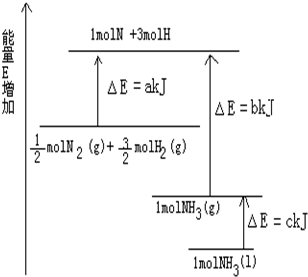 ��֪��ѧ��ӦN2+3H2�T2NH3�������仯��ͼ��ʾ��
��֪��ѧ��ӦN2+3H2�T2NH3�������仯��ͼ��ʾ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com