


科目:高中化学 来源: 题型:
| A、使甲基橙呈黄色的溶液中一定存在K+、Ba2+、AlO2-、Cl- |
| B、同一主族元素气态氢化物中,相对分子质量越大,沸点越高 |
| C、Al2O3与AlCl3虽然所含的化学键类型不同,但都属于强电解质 |
| D、将过量Na2O2投入紫色石蕊溶液,溶液显蓝色,Na2O2是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C是正极,发生氧化反应 |
| B、C是负极,发生氧化反应 |
| C、Fe是正极,发生还原反应 |
| D、Fe是负极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
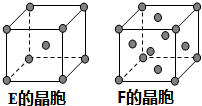 已知A、B、C、D、E、F六种元素的原子序数依次递增,A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、E的原子序数相差10,F+的M层电子全充满.请回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
已知A、B、C、D、E、F六种元素的原子序数依次递增,A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、E的原子序数相差10,F+的M层电子全充满.请回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ?mol-1 | a | b | c |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
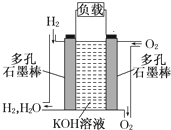 如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题:
如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
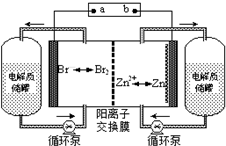 锌溴液流电池是一种新型电化学储能装置(如图),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A、充电时电极a连接电源的负极 |
| B、放电时负极的电极反应式为Zn-2e-=Zn2+ |
| C、放电时左侧电解质储罐中的离子总浓度增大 |
| D、阳离子交换膜可阻止Br2与Zn直接发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com