
����Ŀ��(1)Ǧ���仯������������أ������豸�� X ���߷������ϵȡ��ش��� �����⣺
��Ǧ��̼��ͬ��Ԫ�أ���̼�� 4 �����Ӳ㡣Ǧ��ԭ�ӽṹʾ��ͼΪ_____��Ǧ������������Ӧˮ��������Ա�̼���______(����ǿ����������)��
��PbO2 ��Ũ���Ṳ�����ɻ���ɫ���壬��Ӧ�Ļ�ѧ����ʽΪ_____��
��Ǧ���طŵ�ʱ��������ӦʽΪ_____ ������·���� 2mol ����ת��ʱ�����������缫�����仯�IJ�Ϊ_____g��
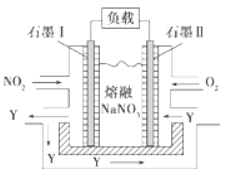
(2)NO2��O2 ������ NaNO3 ������ȼ�ϵ�أ���ԭ������ͼ��ʯī��Ϊ��ص�_____�����õ����ʹ�ù�����ʯī��缫������������ Y����缫��ӦʽΪ_____��
���𰸡� �� PbO2+4HCl��PbCl2+Cl2��+2H2O PbO2+2e�\+4H++SO42�\=PbSO4+2H2O 32 �� 02+2N2O5+4e-��4NO3-
�� PbO2+4HCl��PbCl2+Cl2��+2H2O PbO2+2e�\+4H++SO42�\=PbSO4+2H2O 32 �� 02+2N2O5+4e-��4NO3-
��������
(1)��Ǧ��̼��ͬ��Ԫ�أ���̼�� 4 �����Ӳ㣬��ǦΪ�������ڢ�AԪ�أ�Ǧ��ԭ�ӽṹʾ��ͼΪ ���ǽ�����Խ��������������������Խ������Ǧ������������Ӧˮ��������Ա�̼�������
���ǽ�����Խ��������������������Խ������Ǧ������������Ӧˮ��������Ա�̼�������
��PbO2 ��Ũ���Ṳ�����ɻ���ɫ���壬ͬʱ�����Ȼ�Ǧ��ˮ����Ӧ�Ļ�ѧ����ʽΪPbO2+4HCl��PbCl2+Cl2��+2H2O��
��Ǧ���طŵ�ʱ�������õ�����,������ԭ��Ӧ,�缫��ӦΪ: PbO2 + 2e-+ 4H+ + SO42-=PbSO4 + 2H2O ,����2mol����ת��ʱ,������������303g��239g��64g��Ǧ���طŵ�ʱ�ĸ���ʧȥ����, ����������Ӧ���缫��ӦΪ: Pb- 2e- +SO42-=PbSO4 ,����2mol����ת��ʱ,������������96g ,�����缫�����仯�IJ�Ϊ96g-64g=32g��
(2) NO2��O2������NaNO3������ȼ�ϵ��,ʯīIͨ��NO2 ,ʧȥ����, ����������Ӧ,���Ϊ����,�缫��ӦΪ: NO2-e- + NO3- =N2O5��ʯī��Ϊ����,�õ�����,������ԭ��Ӧ,�缫��ӦΪ: 02+2N2O5+4e-=4NO3-��


 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�ͱ��ӵĻ��Һ�м���Ũ��ˮ��Ȼ������Գ�ȥ���ӡ���_______��
(2)����մ��Ƥ���Ͽ���������������Һϴ�ӡ���_______��
(3)���������ԣ��������������ʡ���_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2SO3��Һ�Ͳ�ͬ��������������ҺΪʵ�����̽���ε����ʺ�����Һ�䷴Ӧ�Ķ�����
ʵ�� | �Լ� | ���� | ���� ��� | |
�ι� | �Թ� | |||
2 mL | 0.2 mol��L1 Na2SO3��Һ | ����Ag2SO4��Һ | ��.������ɫ���� | ����ΪAg2SO3 |
0.2 mol��L1 CuSO4 | ��.��Һ���̣������μӲ����ػ�ɫ���� | ���ﺬCu+��Cu2+��SO32 | ||
0.1 mol��L1 Al2(SO4)3��Һ | ��.��ʼ�����Ա仯�������μӲ�����ɫ���� | ����Ϊ Al(OH)SO3 | ||
����˵������ȷ����
A. ������Ӧ�����ӷ���ʽ��Ag2SO4(s) + SO32(aq) === Ag2SO3(s) + SO42(aq)
B. ��ϡ����֤ʵ������к���Cu+��ʵ��������������ɫ����
C. ������а�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ
D. ����ʵ�������漰���������ε��ܽ��ԡ�������ԭ�Լ���ˮ��Һ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͬ��Ba(OH)2��Һ�У��ֱ�������ʵ���Ũ����ȵ�H2SO4��NaHSO4��Һ���䵼�������������Һ����仯��������ͼ��ʾ�����з�����ȷ����
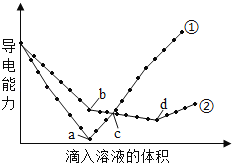
A. �ڴ����μ�H2SO4��Һ�ı仯����
B. b�㣬����Ӧ�����ʵ���֮��Ϊ1: 2
C. a��d�����Ӧ����Һ��������
D. c�㣬����Һ�к�����ͬ���ʵ���Ũ�ȵ�OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ���ǣ� ��
A.������������Һ��ϴմ��Ƥ���ϵı���B.��Ũ�������հ����е�ˮ��
C.��ϡ����ϴȥ�������Թ��ڱ��ϵ���D.�þƾ���ȡ��ˮ�еĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һ�����ȡ��ݻ�������ܱ������з������淴Ӧ��N2��g��+3H2��g��![]() 2NH3��g����H��0�����и�����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����________��
2NH3��g����H��0�����и�����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����________��
A�������������ܶȱ��ֲ���
B���������¶Ȳ��ٱ仯
C������1mol N��N����ͬʱ������6mol N��H��
D����Ӧ����N2��H2�����NH3������֮��1��3��2
��2����֪����Zn(s)��1/2O2(g) = ZnO(s) ��H =��348.3 kJ/mol
��2Ag(s)��1/2O2(g) = Ag2O(s) ��H =��31.0 kJ/mol
��Zn(s)��Ag2O(s) = ZnO(s)��2Ag(s)�ġ�H=________ kJ/mol��
��3����֪�����Ȼ�ѧ����ʽ��
C(s)��O2(g)==CO2(g) ��H = ��393.5kJ/mol
2H2(g)��O2(g)==2H2O(g)��H = ��483.6kJ/mol
����0.2mol̿�ۺ�H2�����������ʹ����O2����ȫȼ�գ����ų�63.53kJ����������̿����H2�����ʵ���֮����________��
��4����ˮ��Һ����YO3n����S2��������Ӧ�����ӷ���ʽ������YO3n�� + 3S2�� + 6H+ = Y��+ 3S��+ 3H2O
��YO3n����Y�Ļ��ϼ���_____________��
��YԪ��ԭ�ӵ�������������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������г�������ʵ�����A��B��һ���¶��·�����ӦA(g)��xB(g)![]() 2C(g)���ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı�Ӱ�췴Ӧ��һ��������������������ʵ����ʵ���Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯����ͼ��ʾ��
2C(g)���ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı�Ӱ�췴Ӧ��һ��������������������ʵ����ʵ���Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯����ͼ��ʾ��

����˵������ȷ����
A. 30��40 min��÷�Ӧʹ���˴���
B. ��Ӧ����ʽ�е�x��1������ӦΪ���ȷ�Ӧ
C. 30 minʱ�����¶ȣ� 40 minʱ�����¶�
D. 8 minǰA��ƽ����Ӧ����Ϊ0.08 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��22.4LCl2��1molCl2��ȣ�����˵������ȷ����( )
A.���һ�����B.������Ŀһ�����
C.�ܶȿ������D.����һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵����� ��
A. H2��I2��HIƽ��������ѹ����ɫ���� B. ʵ�����г����ű���ʳ��ˮ�ķ����ռ�Cl2
C. �ϳɰ�������500 �����ҵ��¶� D. SO2��������SO3�ķ�Ӧ��������Ҫʹ�ô���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com