
【题目】下列离子在指定条件下一定能大量共存的一组是:( )
A. c(H+)/c(OH—)=105的溶液中:Na+、ClO-、K+、Cl-
B. 由水电离出的C(H+)=1×10-13mol/L的溶液中:NH4+、Fe2+、Cl-、SO42-
C. 使酚酞变红色的溶液中:NO3-、Cl-、Ca2+、Na+
D. 使甲基橙变红色的溶液中:NO3-、Al3+、NH4+、SO42-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】金属铬是硬度最高的金属,常用于制造不锈钢和仪器仪表的金属表面镀铬,可用铬铁矿(主要成分为FeCr2O4,含有SiO2、Al2O3等杂质)冶炼金属铬。回答下列问题:
I.焦炭冶炼法。反应的化学方程式为FeCr2O4+4C![]() Fe+2Cr+4CO ,该方法的优点是过程简单,主要缺点是___。
Fe+2Cr+4CO ,该方法的优点是过程简单,主要缺点是___。
Ⅱ.铝热冶炼法。冶炼流程如下:
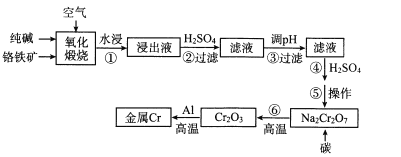
已知:4FeCr2O4+8Na2CO3 +7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①所得浸出液中的阴离子除CrO42-、CO32-、OH-外,还有____(忽略水解,填化学式)。
(2)步骤③需将pH调____(填“大”或“小”)。
(3)步骤④反应的离子方程式为____。若加H2SO4前c(CrO42-) =0. 020 mol/L,将溶液pH调至3时CrO42-浓度降为1.0×10-5 mol/L(加入H2SO4引起的体积变化可忽略),则该反应的平衡常数为____
(4)相关物质的溶解度曲线如图。步骤⑤需先得到较纯的 Na2Cr2O7·2H2O晶体,其操作方法是____。

(5)步骤⑥除生成Cr2O3外,还生成了Na2CO3和CO,该反应中氧化剂与还原剂的物质的量之比为 ___。可改用Na2 CrO4和Na2S反应得到Cr(OH)3,再热分 解得到Cr2O3。请配平下列化学方程式:___Na2CrO4+___Na2S+___H2O =___Cr(OH)3+___Na2 S2O3+___NaOH___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热定容的密闭容器中,1molA 与 2molB 发生反应 A(g)+2B(g) ![]() xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
A. 充分反应后,放出热量为 b kJ
B. 若 x=1,容器中压强不变时不能判断反应达到平衡
C. 当 B 和 D 的物质的量为 1:1 时,表明该反应已达到平衡
D. 达到平衡过程中,正反应速率可能是先增大再减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
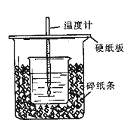
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种微粒的结构示意如下,下列说法错误的是( )

A.它们属于不同种元素
B.它们的核外电子排布相同
C.它们都是离子
D.它们都具有稀有气体原子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系正确的是:( )
A. pH=3的盐酸和pH=11的氨水等体积混合:c(NH4+)=c(Cl-)>c(H+)=c(OH-)
B. 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+ c(OH-)
C. pH=8.3的NaHCO3溶液c(Na+)>c(HCO3-)> c(H2CO3) > c(CO32-)
D. 0.2mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合:2c(H+)—c(OH-)=c(CH3COO-)—c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式_______________________________。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1= +48 kJ·mol1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2= 30 kJ·mol1
则反应4SiHCl3(g)=SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
(3)对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是___________;要缩短反应达到平衡的时间,可采取的措施有____________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂空气电池能量密度高、成本低,可作为未来电动汽车的动力源,其工作原理如右图所示。下列有关该电池的说法正确的是

A. 充电时,金属锂为阳极
B. 放电时,正负两极周围都有LiOH
C. 放电时,每消耗22.4LO2,转移4mol电子
D. 放电和充电时,Li+迁移方向相反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是

A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com