
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
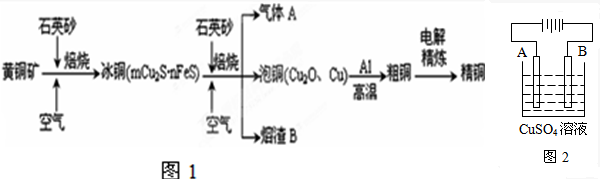
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象与结论 |
| 步骤1:在试管中加入MnO2,然后滴加4mol/L稀盐酸, | |
| 步骤2:在试管中加入MnO2,然后滴加4mol/L稀盐酸, |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有④ | B、只有②③ |
| C、只有③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据:
某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据:| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该晶体中每个氮原子与其它3个氮原子相连 |
| B、该晶体属于原子晶体,它与N2属于同素异形体 |
| C、高聚氮爆炸后生成氮气放出大量的热,所以理论上该高聚氮可作为高能炸药 |
| D、高聚氮转化为氮气是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com