
| A. | A的平均反应速率为0.15mol•L-1•min-1 | |
| B. | 恒温下达到平衡的标志是C和A的生成速率相等 | |
| C. | 降低平衡体系的温度,逆反应速率变小,正反应速率增大 | |
| D. | B的转化率为25% |
分析 5min达平衡,此时生成2molC,v(C)=$\frac{\frac{2mol}{4L}}{5min}$=0.1mol•L-1•min-1,测得D的平均反应速率为0.1mol•L-1•min-1.由速率之比等于化学计量数之比可知,x=2,则
3A(g)+B(g)?2C(g)+2D(g)
开始 6 5 0 0
转化 3 1 2 2
平衡 3 4 2 2
A.结合v=$\frac{△c}{△t}$计算;
B.平衡时不同物质的正逆反应速率之比等于化学计量数之比;
C.降温温度,正逆反应速率均减小;
D.转化率=$\frac{转化的量}{开始的量}$×100%.
解答 解:5min达平衡,此时生成2molC,v(C)=$\frac{\frac{2mol}{4L}}{5min}$=0.1mol•L-1•min-1,测得D的平均反应速率为0.1mol•L-1•min-1.由速率之比等于化学计量数之比可知,x=2,则
3A(g)+B(g)?2C(g)+2D(g)
开始 6 5 0 0
转化 3 1 2 2
平衡 3 4 2 2
A.A的平均反应速率为$\frac{\frac{3mol}{4L}}{5min}$=0.15mol•L-1•min-1,故A正确;
B.平衡时不同物质的正逆反应速率之比等于化学计量数之比,则平衡时C和A的生成速率为2:3,故B错误;
C.降温温度,正逆反应速率均减小,且平衡正向移动,正反应速率大于逆反应速率,故C错误;
D.B的转化率为$\frac{1mol}{5mol}$×100%=20%,故D错误;
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率及转化率计算、平衡判定为解答的关键,侧重分析与计算能力的考查,注意x的确定方法,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
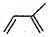 )是合成天然橡胶的单体.请回答下列问题:
)是合成天然橡胶的单体.请回答下列问题: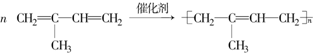 ,该反应类型为加聚反应.
,该反应类型为加聚反应.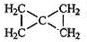 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol | B. | 2SO2(g)+O2(g)=SO3(g)△H=-196.6kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol | D. | 2H2(g)+O2(g)=2H2O(l)△H=-517.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
| A. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5kJ/mol | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183kJ/mol | |
| C. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=+91.5kJ/mol | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Cl2 | Br2 | I2 | H2 | HCl | HI | HBr |
| 键能/(kJ•mol-1) | 243 | 193 | 151 | 436 | 431 | 298 | 366 |
| A. | Cl2 | B. | Br2 | C. | I2 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和硫酸铜溶液反应:2Na+Cu2+═Cu2+2Na+ | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合2AlO2-+5H+═Al3++Al(OH)3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com