
(10分) 按要求完成下列填空
(1)写出下列物质的电离方程式:
Fe2(SO4)3_____________________________________________,
NaHCO3______________________________________________;
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应___________________________________,
氢氧化钡溶液与稀硫酸反应_______________________________;
(3)写出与下列离子方程式相对应的化学方程式:
H+ + OH- == H2O _______________________________________,
CO32- + 2H+ == CO2↑+ H2O_______________________________。
(1)Fe2(SO4)3==2Fe3+ + 3SO42- (1分) ,NaHCO3==Na+ + HCO3-(1分)
(2)CaCO3 + 2H+ == Ca2+ + CO2↑+ H2O(2分)
Ba2+ + 2OH- + 2H+ + SO42-== BaSO4 ↓+ 2H2O(2分)
(3) HCl + NaOH == NaCl + H2O(2分)
Na2CO3 + 2HCl ==2NaCl+ CO2↑+ H2O(2分)(其他合理答案也可得分)
【解析】
试题分析:(1)Fe2(SO4)3电离产生Fe3+和SO42‾;NaHCO3为弱酸的酸式盐,电离产生Na+和HCO3‾。
(2)CaCO3难溶,不能拆成离子,HCl和CaCl2为易溶的强电解质,拆成离子,化简后可得离子方程式;Ba(OH)2为能溶的强碱,H2SO4为易溶的强酸,拆成离子,BaSO4难溶,H2O难电离,不能拆开。
(3) H+ + OH- == H2O,强酸与强碱反应生成可溶盐和水都可以;CO32- + 2H+ == CO2↑+ H2O,可溶性的碳酸盐和强酸反应生成可溶性盐、CO2、H2O都可。
考点:本题考查电离方程式、离子方程式、化学方程式的书写。


科目:高中化学 来源: 题型:
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许. | |
| 2 | 用胶头滴管向甲、乙试管中逐滴滴加BaCl2溶液至过量. | |
| 3 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州市楠江中学高二下学期期末考试化学试卷(带解析) 题型:实验题
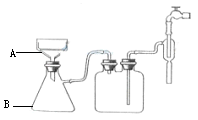
(10)按要求完成硝酸钾晶体的制备实验:
| 步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
| ① | 溶解 | 取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 | 固体溶解 |
| ② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩。 | 有 a 晶体析出。 |
| ③ | 热过滤 | 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为 b 。 |
| ④ | 冷却 | 将滤液冷却至室温。 | 有晶体析出。 |
 ⑤ ⑤ | | 按有关要求进行操作 | 得到初产品硝酸钾晶体 |
| ⑥ | | 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 | 得到纯度较高的硝酸钾晶体 |
| ⑦ | 检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象。 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三第二次月考化学试卷(解析版) 题型:计算题
(13分)按要求完成下列各小题。
(1)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g) CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
|
化学键 |
C-C |
C-H |
H-H |
C-O |
C=O |
H-O |
|
键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
750 |
463 |
计算反应上述反应的焓变△H=_______________________
写出上述反应的平衡常数表达式K=__________________,若升高温度,则平衡常数K________(填“增大”或“减小”或“不变”)。该反应的△S______0(填“>”或“<”或“=”),在 _________(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为________________。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(3)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(4)在25℃时,将cmol·L-1的醋酸溶液与0.02mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省温州市高二下学期期末考试化学试卷(解析版) 题型:实验题
(10)按要求完成硝酸钾晶体的制备实验:
|
步骤 |
操作 |
具体操作步骤 |
现象解释结论等 |
|
① |
溶解 |
取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 |
固体溶解 |
|
② |
蒸发 |
继续加热搅拌,使溶液蒸发浓缩。 |
有 a 晶体析出。 |
|
③ |
热过滤 |
当溶液体积减少到约原来的一半时,迅速趁热过滤 |
滤液中的最主要成分为 b 。 |
|
④ |
冷却 |
将滤液冷却至室温。 |
有晶体析出。 |
|
|
|
按有关要求进行操作 |
得到初产品硝酸钾晶体 |
|
⑥ |
|
将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 |
得到纯度较高的硝酸钾晶体 |
|
⑦ |
检验 |
分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 |
可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象。 |
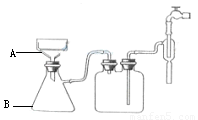
(1)把上述各步骤中的内容补充完整:a: b:
(2)写出步骤③趁热过滤的目的 ,步骤⑥的操作名称 ,步骤⑦中产生白色沉淀的离子方程式
(3)步骤⑥的抽滤装置如图所示,仪器A的名称 ,该装置中的错误之处是 ; 抽滤完毕或中途需停抽滤时,应先 ,然后 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com