
| A. | 羟基的电子式: | B. | CH4分子的比例模型: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 1,2-二甲基丁烷的结构简式为: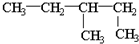 |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑩ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
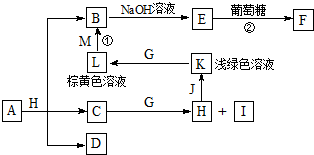 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
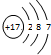 ,关于该粒子的说法不正确的是( )
,关于该粒子的说法不正确的是( )| A. | 核电荷数为17 | B. | 该粒子的化学式为Cl- | ||
| C. | 元素的最低化合价为-1 | D. | 与活泼金属反应时容易得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 流水、风力是一次能源,电力、蒸汽是二次能源 | |
| B. | 普通锌锰电池是一次电池,碱性锌锰电池是二次电池 | |
| C. | 铅蓄电池是一次电池,氢氧燃料电池是二次电池 | |
| D. | 同周期元素形成的简单离子中,原子序数越大的离子半径越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
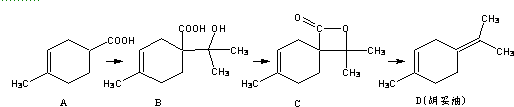
| A. | 1molA可与2molNaOH完全反应 | |
| B. | 如果条件合适,B可能发生加聚反应,也可能发生缩聚反应 | |
| C. | 有机物C的所有同分异构体中不可有芳香族化合物存在 | |
| D. | D 与Br2的CCl4溶液反应,最多有4种生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
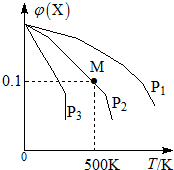 某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )| A. | 升高温度,该反应平衡常数K减小 | B. | 压强大小有P3>P2>P1 | ||
| C. | 平衡后加入高效催化剂使Mr增大 | D. | 在该条件下M点X平衡转化率为$\frac{9}{11}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验. 序号 | 碳酸钙 | C(HCl)/ mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com