
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 1000 mol |
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论及有关化学方程式 |
| A.分别称取相同质量的样品,在空气中燃烧; B.分别称量硫化铜和硫化亚铜灼烧后剩余物质的质量 | A.有一种固体无变化,两种固体产生刺激性气味气体 B.有一种样品质量减轻,一种样品质量不变 | A.固体无变化的是氧化铜,产生刺激性气味气体的是硫化铜和硫化亚铜,在空气中煅烧中反应的化学方程式分别为2CuS+3O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2; Cu2S+2O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 B.质量减轻的是硫化铜,质量不变的是硫化亚铜 |
| 实验装置 | 现象 |
 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 预期现象及实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应用托盘天平称取20g NaOH固体 | |
| B. | 配制过程中所用玻璃棒的作用是搅拌和引流 | |
| C. | NaOH固体在烧杯中称量时间过长,所配NaOH溶液的浓度偏大 | |
| D. | 定容摇匀后,发现液面下降,继续加水至刻度线,对所配NaOH溶液的浓度无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20 mL 3 mol•L-1的盐酸溶液 | B. | 20℃30 mL 2 mol•L-1的盐酸溶液 | ||
| C. | 20℃20 mL 2 mol•L-1的盐酸溶液 | D. | 20℃10 mL 4 mol•L-1的盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
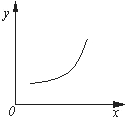 汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )| 选项 | x | y |
| A | 压强 | 气体的平均相对分子质量 |
| B | 温度 | 平衡常数K |
| C | NO的浓度 | NO的转化率 |
| D | 温度 | 容器内混合气体的密度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 向NaAlO2溶液中通入过量CO2:2 AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅与任何酸都不反应 | |
| B. | 硅是构成矿物岩石的主要原料,其化合态硅几乎全部是硅石(成份为SiO2)和硅酸盐 | |
| C. | 硅的性质很稳定,能以游离态存在于自然界 | |
| D. | 常温时硅不与任何物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:AO、BP、CCl.A的原子结构示意图为
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:AO、BP、CCl.A的原子结构示意图为 ,B在周期表中的位置第三周期第VA族,C的离子结构示意图为
,B在周期表中的位置第三周期第VA族,C的离子结构示意图为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com