
【题目】甲、乙两烧杯各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向烧杯分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=3∶4,则加入铝粉的质量为
A. 1.8 g B. 2.7 g C. 3.6 g D. 5.4 g
【答案】C
【解析】
本题主要考查铝的化学性质以及化学方程式的有关计算。根据铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,反应结束后测得生成的气体体积比为甲:乙=3:4,由化学反应方程式可知,酸与金属反应时酸不足,碱与金属反应时碱过量来计算解答。
盐酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol,又两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=3:4,
设铝与酸反应时,酸完全反应,生成的氢气的物质的量为x,
则 2Al+6HCl═2AlCl3+3H2↑
6 3
0.3mol x
![]() ,解得x=0.15mol,一定条件下,气体的物质的量之比等于体积之比,则碱与金属铝反应生成的氢气的物质的量为0.15mol×
,解得x=0.15mol,一定条件下,气体的物质的量之比等于体积之比,则碱与金属铝反应生成的氢气的物质的量为0.15mol×![]() =0.2mol,
=0.2mol,
碱与金属铝反应时,铝完全反应,设与碱反应的铝的物质的量为y,
则2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.2mol![]() ,解得y=
,解得y=![]() mol,其质量为
mol,其质量为![]() mol×27g/mol=3.6g。
mol×27g/mol=3.6g。


科目:高中化学 来源: 题型:
【题目】微型直接甲醇燃料电池能量密度高,可应用于各类便携式电子产品,其工作原理如图所示。下列说法不正确的是
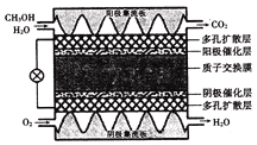
A. 多孔扩散层可起到传导电子的作用
B. 负极上直接通入无水甲醇可提高电池的比能量
C. 当电路中通过3mol e- 时,内电路中有3mol H+ 透过质子交换膜
D. 电池工作时,H+ 向阴极催化层迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
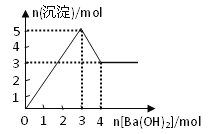
A. MgSO4 B. KAl(SO4)2 C. Al2(SO4)3 D. NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
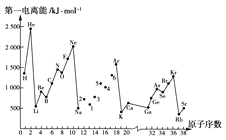
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na~Ar之间的元素用短线连接起来,构成完整的图象________。
(2)从上图分析可知,同一主族元素原子的第一电离能I1的变化规律是_________。
(3)上图中5号元素在周期表中的位置是_________________________________。
(4)上图中4、5、6号三种元素的气态氢化物的化学式分别为__________________。
(5)上图中1~6号元素中,最高价氧化物对应水化物中酸性最强的是_______,两性化合物有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验能得出相应结论的是
选项 | 实验 | 结论 |
A | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/L Na2CO3溶液的pH | 酸性:HA>H2CO3 |
B | 向含有淀粉的FeI2溶液中加入足量溴水,溶液变蓝色 | 还原性:I->Fe2+ |
C | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
D | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 氯气跟水反应:Cl2 + H2O= 2H++ Cl-+ ClO-
B. 食醋与氨水反应:NH3·H2O+H+= NH4++H2O
C. NaHCO3溶液中加少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D. 向Ba(OH)2溶液滴加NaHSO4溶液至Ba2+恰好沉淀:Ba2++2H++2OH-+SO42- = BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
(1)检查A装置气密性的方法是____________________________________。该装置中产生ClO2的化学方程式为_________________________________________。
(2)实验过程中需要持续通入空气,目的是_________________________________。
(3)NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是________(填代号)。
a.石蕊 b.酚酞 c.pH试纸 d.pH计
(4)B装置中发生反应的离子方程式为______________________________________;使用冰水浴的原因是_________________________________;反应结束后,从溶液中得到NaClO2固体的实验操作是____________________________________________________。
(5)NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是由A和CH2=CH2为主要原料合成的一种高分子酯类物质,合成路线如下(部分产物及条件已略去):
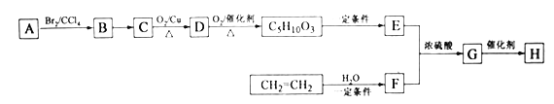
已知:①A的结构简式为: 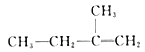
②E分子的核磁共振氢谱峰有4个,峰面积比为3:3:1:1.
(1)A的化学名称为__________
(2)F的结构简式为_________,B到C的反应条件是_________
(3)生成G的反应类型为_________,H的结构简式是_______,若H的平均相对分子质量为25600,则H的平均聚合度约为________
(4)C![]() D的化学方程式为_________
D的化学方程式为_________
(5)E有多种同分异构体,其中符合下列条件的同分异构体共有________种。
①能发生水解反应和银镜反应
②没有环状结构
③不含![]() 结构。
结构。
(6)写出以乙二醇为基本原料(其他试剂自选)合成聚乙二酸乙二酯的合成路线图(参照乙烯转化为F的格式)_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com