
 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:| 物质(mol) 时间 | NO | CO | N2 | CO2 |
| 起始 | 0.40 | 1.0 | ||
| 2min 末 | 2.0 | 0.80 | 1.6 | |
| 4min 末 | 1.6 |
分析 (1)反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
盖斯定律计算反应Ⅰ×2-反应Ⅱ-反应Ⅲ得到2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•mol-1,
故答案为:-746.5 kJ•mol-1;
(2)①0~2min 内N2物质的量变化=1.0mol-0.80mol=0.20mol,根据v=$\frac{△c}{△t}$计算出v(N2),然后根据 v(CO)=2v(N2)计算出用CO表示的反应速率;
0~2min 内用 CO物质的量变化=1.0mol-0.80mol=0.20mol,反应速率v=$\frac{△c}{△t}$;
②利用三段式列式计算该反应的平衡常数;
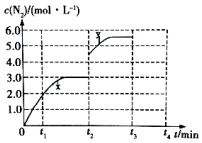
(3)①t2min时改变一个条件后,c(N2)瞬间从3.5mol/L变为4.5mol/L,说明改变条件是将容器容积从3L迅速变为2L;
②升高温度后平衡向着逆向移动,氮气的浓度减小,之至t3min时重新达到平衡,据此画出图象.
解答 解:(1)反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
盖斯定律计算反应Ⅰ×2-反应Ⅱ-反应Ⅲ得到
故答案为:-746.5 kJ•mol-1;低温;
(2)①0~2min 内N2物质的量变化为:1.0mol-0.80mol=0.20mol,用 CO 来表示的平均反应速率 v(CO)=2v(N2)=$\frac{\frac{0.20mol}{2L}}{2min}$×2=0.10mol/(L•min),
故答案为:0.10mol•Lˉ1•minˉ1;
②根据标准数据可知,2min 末达到平衡状态
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol/L)0.2 0.8 0.5 1.0
变化量(mol/L)0.2 0.2 0.1 0.2
平衡量(mol/L)0.4 1.0 0.4 0.8
该温度下反应Ⅳ的化学平衡常数K=$\frac{0.{8}^{2}×0.4}{1.{0}^{2}×0.{4}^{2}}$=1.6,
故答案为:1.6;
(3)①根据图象可知,t2min时条件后,c(N2)瞬间从3.5mol/L变为4.5mol/L,说明改变条件压缩容器容积,即将容器容积从3L迅速变为2L,
故答案为:快速将容器体积由3L压缩到2L;
②该反应为放热反应,升高温度后平衡向着逆向移动,则 c(N2)开始减小,之至t3min时重新达到平衡,c(N2)不再变化,据此画出t2~t4内 c(N2)的变化曲线为: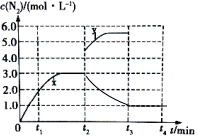 ,
,
故答案为: .
.
点评 本题考查物质的量或浓度随时间变化的曲线、反应热与焓变等知识,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析、理解能力及综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑的现象,说明浓硫酸具有脱水性 | |
| B. | Na的金属活动性比Mg强,说明可用Na与MgCl2溶液反应制Mg | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸反应生成了致密的氧化物 | |
| D. | 向碘水中滴加CCl4,振荡静置后分层,下层呈紫红色,说明可用CCl4从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制氯乙烷:CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | 制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH $\stackrel{Pd}{→}$ CH2=C(CH3)COOCH3 | |
| C. | 制CuSO4:2Cu+O2=2CuO,CuO+H2SO4(稀)═CuSO4+H2O | |
| D. | 制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
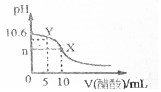 已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )
已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )| A. | n=7 | |
| B. | 水的电离程度先增大再减小 | |
| C. | 常温下醋酸的电离常数约是1.67×10-5 | |
| D. | Y点溶液中c(NH3•H2O)+c(OH-)=c(CH3COO-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 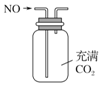 用图所示装置(正放)可收集NO气体 | |
| B. | 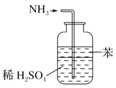 用图所示装置可吸收多余氨气且能防止倒吸 | |
| C. | 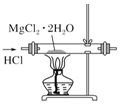 用装置制取无水MgCl2 | |
| D. | 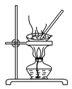 用装置蒸干NH4Cl饱和溶液获取NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com