
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下。
(1)以N2和H2为原料合成氨气。反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
①该反应的化学平衡常数表达式是K= 。
②该反应的化学平衡常数K与温度T的关系如下表所示:
| T / K | 473 | 573 | 673 | …… |
| K | 4.4×10-2 | K1 | K2 | …… |
其中,K1 K2(填“>”、“=”或“<”)。
③ 下列措施可以提高H2的转化率的是(填选项序号)____________________。
a.选择适当的催化剂
b.增大压强
c.及时分离生成的NH3
d.升高温度
④ 一定温度下,在密闭容器中充入1 mol N2和3 mol H2发生反应。
(Ⅰ)若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,
,
求N2的转化率α1。(用三列式作答,要求写出计算过程)
(Ⅱ)若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2 α1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
① NH3被氧气催化氧化生成NO的反应的化学方程式是_________________。
② 在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) ΔH>0。该反应的反应速率(υ)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)___________________。
2NO2(g) ΔH>0。该反应的反应速率(υ)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)___________________。
 |
a.在t1 ~ t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3 ~ t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g)=2H2O(g) ΔH=— 483.6 kJ/mol
N2(g) + 2O2(g)=2NO2(g) ΔH=+ 67.7 kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是_____________ 。
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
工业上生产MnO2和Zn的主要反应有
① MnO2 + ZnS + 2H2SO4 = MnSO4 + ZnSO4 + S + 2H2O
② MnSO4 + ZnSO4 + 2H2O MnO2 + Zn + 2H2SO4
MnO2 + Zn + 2H2SO4
下列说法不正确的是
A.①中MnO2和H2SO4都是氧化剂
B.①中析出16 g S时转移1 mol 电子
C.②中MnSO4发生氧化反应
D.硫酸在该生产中可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
250℃和1.01×105 Pa时, 2N2O5(g) = 4NO2(g) + O2(g) △H= +56.76 kJ/mol,该反应能自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于焓效应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=13的氨水溶液稀释至10倍后pH=12
C.0.2 mol/L的盐酸与等体积水混合后pH=1
D.pH=12的氨水溶液与pH=2的氢氧化钠溶液等体积混合后pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
请认真观察右图,然后回答问题:
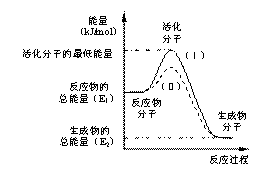 (1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=___________ (用含E1、E2的代数式表示)。
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=___________ (用含E1、E2的代数式表示)。
(2)已知热化学方程式:
H2(g)+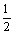 O2(g)= H2O(g)
O2(g)= H2O(g)
△H=-241.8 kJ/mol,
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为_______________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能 ,活化分子百分数 ,反应速率 ,(Ⅱ)相对(Ⅰ)改变的外界条件是_________。这一改变对反应热_________(填“有”、“无”)影响,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质比较,正确的是( )
A.酸性:H2SO4>HClO4 B.碱性:NaOH>KOH
C.非金属性: P>S D.气态氢化物稳定性: HCl>H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于煤、石油、天然气等资源的说法正确的是 ( )。
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化石燃料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。 某种锂电池的总反应式是Li+MnO2 = LiMnO2。下列说法正确的是
A. Li是负极,电极反应为Li+e-=Li+
B. Li是正极,电极反应为Li+e-=Li-
C. MnO2是负极,电极反应为MnO2+e-=MnO2-
D. 锂电池是一种环保型电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com