
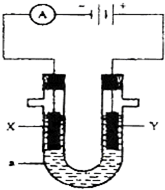
 如图为电解装置,X、Y为电极材料,a为电解质溶液.
如图为电解装置,X、Y为电极材料,a为电解质溶液.| 1.08g |
| 108g/mol |


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:

| 石灰乳 |
| HCl |
| 电解 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中.
将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高空臭氧层吸收太阳紫外线,保护地球生物;低空臭氧是污染气体,对人体有危害 |
| B、H7N9型禽流感病毒通常检测方法是直接检测病原体核酸.核酸一种是蛋白质 |
| C、利用高纯硅可以制成光电池,将光能直接转化为电能 |
| D、燃煤进行脱硫脱硝处理,减少硫的氧化物和氮的氧化物的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑤⑦ |
| B、①②④⑥⑦ |
| C、②③④⑤⑥ |
| D、①②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠 | B、氧化钠 |
| C、过氧化钠 | D、氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、H2A在水中的电离方程式是:H2A═H++HA-;HA-?H++A2- |
| B、当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| C、等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中大 |
| D、当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)═c(A2-)+2c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com