


科目:高中化学 来源: 题型:
- 4 |
| 级别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
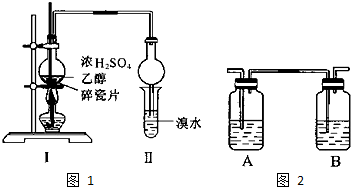 1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.
1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.| H2SO4 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③④⑥ |
| C、②③⑤⑥ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
202 78 |
198 78 |
| A、中子数相同,互称为同位素 |
| B、核外电子数相同,是同一种核素 |
| C、质量数不同,互称为同素异形体 |
| D、质子数相同,互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、金属的导电性强弱 |
| B、金属在地壳中的含量多少 |
| C、金属的化合价高低 |
| D、金属的活动性大小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com