
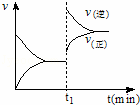
如图为化学反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O (g);△H<0 在一密闭容器中反应的v﹣t图.下列叙述不符合如图所给信息的是( )
|
| A. | t1时,向容器中通入一定量的NO气体 |
|
| B. | t1时,缩小容器的体积 |
|
| C. | t1时改变外界单一条件时,该反应的平衡常数不一定变化 |
|
| D. | 从t1开始到新的平衡建立的过程中,平衡向逆反应方移动 |
考点:
化学平衡的影响因素;化学反应速率的影响因素.
专题:
化学平衡专题.
分析:
由图可知,t1时刻改变条件的瞬间,正、逆反应速率都增大,且逆反应速率增大更多,平衡向逆反应方向移动,该反应正反应是体积增大的放热反应,改变条件应可能是增大压强或升高温度,平衡常数只受温度影响,温度不变平衡常数不变,据此结合选项分析.
解答:
解:由图可知,t1时刻改变条件的瞬间,正、逆反应速率都增大,且逆反应速率增大更多,平衡向逆反应方向移动,该反应正反应是体积增大的放热反应,改变条件应可能是增大压强或升高温度,
A.若t1时,向容器中通入一定量的NO气体,瞬间逆反应速率增大、正反应速率不变,与图象不符,故A错误;
B.由上述分析可知,改变条件应可能是增大压强或升高温度,故B正确;
C.由上述分析可知,改变条件应可能是增大压强或升高温度,若为升高温度,平衡常数减小,若为增大压强,平衡常数不变,故C正确;
D.由图可知,t1时刻改变条件的瞬间,正、逆反应速率都增大,且逆反应速率增大更多,平衡向逆反应方向移动,故D正确,
故选A.
点评:
本题考查化学平衡移动图象、外界条件对反应速率的影响等,难度中等,根据改变条件的瞬间正逆速率变化判断平衡方向是关键.


科目:高中化学 来源: 题型:
已知1gH2燃烧生成液态水时放出142.9kJ的热量,以下热化学方程式正确的是( )
|
| A. | 2H2(g)+O2(g)=2H2O(l)△H=﹣142.9kJ•mol﹣1 |
|
| B. | 2H2(g)+O2(g)=2H2O(l)△H=+571.6kJ•mol﹣1 |
|
| C. | 2H2+O2=2H2O△H=﹣571.6kJ•mol﹣1 |
|
| D. | H2(g)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室配制500ml0.2m ol/L的Na2SO4溶液,实验操作有以下步骤:
ol/L的Na2SO4溶液,实验操作有以下步骤:
a.在托盘天平上称量出14g Na2SO4放于烧杯中加适量蒸馏水溶解并冷却至室温;
b.把制得的溶液小心转移至容量瓶中;
c.继续用烧杯向容量瓶中加水至凹液面与刻度线相切;
d.用少量蒸馏水洗涤烧杯和玻璃棒2-3次 ,并将洗涤液都小心注入容量瓶中,并轻轻振荡;
,并将洗涤液都小心注入容量瓶中,并轻轻振荡;
e.将容量瓶瓶塞塞紧,充分摇匀;
f.将所得溶液倒入指定试剂瓶中,贴好标签封存备用。
填写下列空白:
(1)操作步骤的正确顺序是 (填序号)。
(2)本实验用到的基本仪器已有托盘天平(带砝码)、镊子,
还缺少的仪器有 。
(3)上述步骤中有明显错误的是 (填序号)。
(4)下列情况会使所配制溶液浓度偏高的是 (填序号):
①定容时俯视;②定容时仰视;③没有进行上述操作步骤d;④加水时不慎超过了刻度线,发现后用胶头滴管吸出;⑤称量时用的砝码上沾有杂质;⑥容量瓶使用前没有干燥内壁附有水珠。
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒容的容器中进行反应 A(g)⇌2B(g)+C(g);△H>0,若反应物浓度由0.1mol•L﹣1降到0.06mol•L﹣1需20s,那么由0.06mol•L﹣1降到0.024mol•L﹣1,需反应的时间为( )
|
| A. | 等于18s | B. | 等于12s | C. | 大于18s | D. | 小于18s |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 |
|
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
|
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子数 |
|
| D. | 催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,把试管放入盛25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.
试完成下列问题(提示:氢氧化钙的溶解度随温度升高而降低)
(1)实验中观察到的现象是 ;
(2)产生上述现象的原因是.
(3)写出有关反应的离子方程式 .
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”“小于”或“等于”)镁片的盐酸的总能量.

查看答案和解析>>
科目:高中化学 来源: 题型:
将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),反应2s后测得C的浓度为0.6mol/L.下列说法正确的是( )
A. 用物质A表示2 s内的平均反应速率为0.3 mol/(L•s)
B. 用物质B表示2 s内的平均反应速率为0.6 mol/(L•s)
C. 2 s后物质A的转化率为70%
D. 2 s后物质B的浓度为0.35 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子层结构的原子,其相应元素一定属于同一主族的是( )
A. 3p轨道上有2个未成对电子的原子和4p轨道上有2个未成对电子的原子
B. 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子
C. 最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子
D. 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3.
(1)写出下列元素符号:A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程: .
(3)C、D、E的氢化物稳定性由强到弱依次为:(用化学式表示) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com