
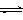 CH3OH(g)��H2O(g) ��H����49.0kJ/mol
CH3OH(g)��H2O(g) ��H����49.0kJ/mol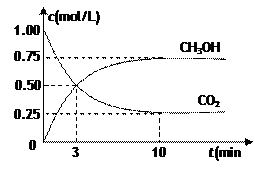

| A�������¶� | B������He(g)��ʹ��ϵѹǿ���� |
| C����H2O(g)����ϵ�з��� | D���ٳ���1mol CO2��3mol H2 |
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2 SO3��Ӧ�������Ӻ�Ӧ�ﵽ��ѧƽ��״̬���������������ѹǿ��Ϊԭ����90% ����÷�Ӧ�ﵽƽ��ʱSO2��ת����Ϊ______________��
2 SO3��Ӧ�������Ӻ�Ӧ�ﵽ��ѧƽ��״̬���������������ѹǿ��Ϊԭ����90% ����÷�Ӧ�ﵽƽ��ʱSO2��ת����Ϊ______________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
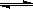 H2 (g)+I2 (g)
H2 (g)+I2 (g) 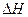 =" +A" kJ��mol
=" +A" kJ��mol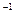 K=4.0��
K=4.0��| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 2 mol HI | 1 mol H2 + 1 1mol I2 | 2 mol HI + 1 mol H2 + 1 mol I2 |
HI��Ũ�ȣ�mol��L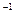 �� �� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�akJ | ����bkJ | ����ckJ |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 |
| ��Ӧ��ת���� | 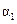 |  | 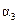 |
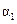 ��
�� �Ĺ�ϵʽΪ
�Ĺ�ϵʽΪ  ƽ�ⳣ������ʽΪ ��
ƽ�ⳣ������ʽΪ ��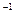 ��min
��min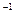 ���ú���c2�Ĵ���ʽ��ʾ��
���ú���c2�Ĵ���ʽ��ʾ�� �������ҡ���������
�������ҡ����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB3(g)���������һ����˵���ÿ��淴Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
2AB3(g)���������һ����˵���ÿ��淴Ӧ�Ѿ��ﵽ��ѧƽ��״̬����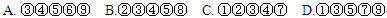
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB(g)�ﵽƽ��ı�־��
2AB(g)�ﵽƽ��ı�־��| A������Ӧ���ʺ��淴Ӧ��������Ҷ�Ϊ�� |
| B���������������ѹǿ����ʱ��仯 |
| C����λʱ��������2n mol AB��ͬʱ����n mol B2 |
| D�������������ƽ����Է�����������ʱ��仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 �źϳɰ���Ӧ��Ӧ��N2(g)+3H2(g)
�źϳɰ���Ӧ��Ӧ��N2(g)+3H2(g) 2NH3(g)����H=-QkJ/mol�����ں��¡���ѹ��������ƽ����ϵ��ͨ���������û�ѧ��Ӧƽ���ƶ� ����������ҡ���������ʹ�ô������Լӿ췴Ӧ���ʣ���ߺϳɰ���ҵ�İ�����������÷�Ӧ�Ħ�H ���������С�����ı䡱����
2NH3(g)����H=-QkJ/mol�����ں��¡���ѹ��������ƽ����ϵ��ͨ���������û�ѧ��Ӧƽ���ƶ� ����������ҡ���������ʹ�ô������Լӿ췴Ӧ���ʣ���ߺϳɰ���ҵ�İ�����������÷�Ӧ�Ħ�H ���������С�����ı䡱���� ����25���£���aL��0.01mol��L-1�İ�ˮ���뵽1L��0.01mol��L-1��������Һ�У�����Ӧ����Һ��c(NH4��)>c(Cl-)������Һ��____�ԣ���ᡱ������С�������a>1����Ӧ������Һ����������Ũ�ȱȽϿ�����ȷ����
����25���£���aL��0.01mol��L-1�İ�ˮ���뵽1L��0.01mol��L-1��������Һ�У�����Ӧ����Һ��c(NH4��)>c(Cl-)������Һ��____�ԣ���ᡱ������С�������a>1����Ӧ������Һ����������Ũ�ȱȽϿ�����ȷ����  ����25���£���Ũ�Ⱦ�Ϊ0.1mol��L-1��MgCl2��CuCl2�����Һ����μ��백ˮ������
����25���£���Ũ�Ⱦ�Ϊ0.1mol��L-1��MgCl2��CuCl2�����Һ����μ��백ˮ�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB3��g�����������е�����ѹǿ���ٱ仯ʱ���AB2��ת����Ϊ80������֪���¶���������Ӧ��ƽ�ⳣ��K=2.0��102����ʼʱ����B2�����ʵ���Ϊ
2AB3��g�����������е�����ѹǿ���ٱ仯ʱ���AB2��ת����Ϊ80������֪���¶���������Ӧ��ƽ�ⳣ��K=2.0��102����ʼʱ����B2�����ʵ���Ϊ| A��0.20 mol | B��0.12 mol | C��0.10 mol | D��0.040 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2NH3��g��
2NH3��g���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com