
����Ŀ��ij�о�С��̽����������泥�NH2COONH4���ֽ�Ļ�ѧƽ���ˮ�ⷴӦ���ʡ�
��1����һ���������İ�����������ڹ̶��ݻ�Ϊ 100mL ���ܱ������Һ A �У��ں㶨�¶���ʹ��ﵽ�ֽ� ƽ�⡣ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶ȣ��棩 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ�����������ʵ�����mol�� | 0.34 | 0.48 | 0.68 | 0.94 |
����������立ֽ�Ļ�ѧ����ʽΪ NH2COONH4(s) 2NH3(g)+CO2(g)���� 25.0��ʱ�ﵽƽ������ʱ��Ϊ8min���������ݼ��� NH3 ��ƽ����������Ϊ__________��
�������жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����_____��
A. 2v(NH3)��=v(CO2)��
B.�ܱ���������ѹǿ����
C. �ܱ������л��������ܶȲ���
D. �ܱ������а����������������
��2����֪��NH2COONH4+2H2O NH4HCO3+NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ�������� ��Һ�ⶨˮ�ⷴӦ���ʣ��õ� c(NH2COO-)��ʱ��仯������ͼ��ʾ������ͼ����Ϣ�����˵��ˮ�ⷴӦ�������¶����߶�����_____��

��3���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ���塣��ҵ�ϳɰ����õĴ�����_____�������ӵĵ���ʽ��_____��
��4����ͼ��һ�����¶Ⱥ�ѹǿ��ʱ N2 �� H2 ��Ӧ���� 1molNH3 �����������仯ʾ��ͼ����д����ҵ�ϳɰ����Ȼ�ѧ��Ӧ����ʽ��__________________________�������� Q ����ֵʹ�ú���ĸ a��b �Ĵ���ʽ��ʾ��

��5���ڴ��������£�NH3 ���������� NO ����Ⱦ���������ֶԻ����������ʡ�д����Ӧ�Ļ�ѧ����ʽ��_____________________���÷�Ӧ�����������뻹ԭ��������ʵ���֮����_______________��
���𰸡�0.4mol/(L��min��BC25�淴Ӧ����ʼŨ�Ƚ�С���� 0��6min ��ƽ����Ӧ���ʣ����ߵ�б�ʣ��Ա� 15�������ý![]() N2(g)+3H2(g)��2NH3(g)
N2(g)+3H2(g)��2NH3(g) ![]() H=+(b-a)kJ��mol��14NH3+6NO
H=+(b-a)kJ��mol��14NH3+6NO ![]() 5N2+6H2O2:3
5N2+6H2O2:3
��������
��1������ѧ��Ӧ����V=��c/��t
�����ݻ�ѧƽ��ı�־���жϣ����淴Ӧ������ͬ�������Ũ�ȱ��ֲ��估�������ĸ��ֹ�ϵ����ƽ���־��
��2����ͼ�����ݿ��Եó����ò�ͬ��ʼŨ�ȣ���ͬ�¶��µ�ƽ�����ʵĴ�С��˵����
��3����ҵ�ϳɰ����õĴ���������ý����������һ����ԭ�Ӻ�������ԭ���γ���������ۼ���
��4����ͼ���N2��H2��Ӧ����1molNH3�ķ�Ӧ�ȣ��ٸ����Ȼ�ѧ��Ӧ����ʽ����д���
��5���ڴ��������£�NH3 ���������� NO ����Ⱦ�����ɵ�����ˮ��д����Ӧ�Ļ�ѧ����ʽ���÷�Ӧ�����������뻹ԭ��������ʵ���֮�ȵ��ڻ�ԭ����������֮�ȡ�
��1������ѧ��Ӧ����V=��c/��t=![]() ==0.4mol/(L��min����
==0.4mol/(L��min����
��A�������Ȳ����ڷ���ʽ������֮������A����ȷ��
B���÷�Ӧ�������������ķ�Ӧ���ʵ�������ѹǿ����ʱ���Ѵﵽƽ�⣬��B��ȷ��
C���÷�Ӧ�������������ķ�Ӧ���ʵ��ܱ������л��������ܶȲ��䣬�Ѵﵽƽ�⣬��C��ȷ��
D����Ӧ�NH2COONH4���ǹ������ʣ������ܱ�������NH3���������ʼ�ղ��䣬Ϊ2/3����D����ȷ��
��ѡ��BC��
��2����25�淴Ӧ����ʼŨ�Ƚ�С����0��6min��ƽ����Ӧ���ʣ����ߵ�б�ʣ��Ա�15���
��3����ҵ�ϳɰ����õĴ���������ý����������һ����ԭ�Ӻ�������ԭ���γ���������ۼ��������ӵĵ���ʽ��![]() ��
��
��4����ͼ��֪��N2��H2��Ӧ����1molNH3�ų�������Ϊ��b-a��kJ���÷�Ӧ���Ȼ�ѧ��Ӧ����ʽΪN2(g)+3H2(g)��2NH3(g) ![]() H=+(b-a)kJ��mol��1��
H=+(b-a)kJ��mol��1��
��5���ڴ��������£�NH3 ���������� NO ����Ⱦ�����ɵ�����ˮ��д����Ӧ�Ļ�ѧ����ʽ4NH3+6NO ![]() 5N2+6H2O���÷�Ӧ�����������뻹ԭ��������ʵ���֮�ȵ��ڻ�ԭ����������֮�ȣ�4��6=2��3��
5N2+6H2O���÷�Ӧ�����������뻹ԭ��������ʵ���֮�ȵ��ڻ�ԭ����������֮�ȣ�4��6=2��3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���� �� ��
A. ��ʯīΪ�缫���MgCl2��Һ��2Cl��+2H2O![]() Cl2+H2��+2OH��
Cl2+H2��+2OH��
B. CuC12��Һ�м��백ˮ��Cu2++2OH�� Cu��OH��2��
C. KI��Һ�е���ϡ���ᣬ��������4H++4I��+O2 2I2+2H2O
D. ��NH4HCO3��Һ�мӹ�����NaOH��Һ�����ȣ�NH![]() +OH��
+OH��![]() NH3��+H2O
NH3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������a��![]() ����b��
����b��![]() ����c��
����c��![]() ������˵������ȷ����
������˵������ȷ����
A. a��b��c��Ϊͬ���칹��
B. b�Ķ��ȴ���������
C. ֻ��a���ܷ����Ӿ۷�Ӧ
D. ����ֻ��c������ԭ�ӿ��ܴ���ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У��������ͼ�������ǣ��� ����
����
A | B | C | D |
NaHSO4��Һ����μ���Ba(OH)2 ��Һ | �������е���NaAlO2��Һ | ��ͭ�ۼ��뵽һ����Ũ������ | �����ۼ��뵽һ�����Ȼ�����Һ�� |
|
|
|
|
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(�׳��Ȼ�������SOCl2)��һ��Һ̬������е�77�棬��ũҩ����ҩ��ҵ���л��ϳɵ�������;�㷺��ʵ���Һϳ�ԭ����SO2+Cl2+SCl2=2SOCl2������װ����ͼ��ʾ��
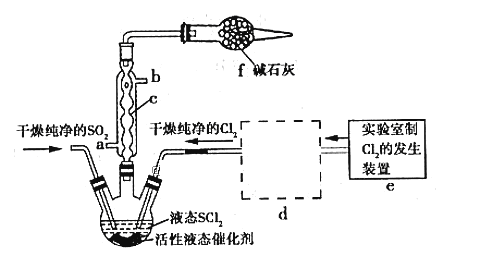
��ش��������⣺
��1������c��������__________________
��2��ʵ�����ö���������Ũ���Ṳ�ȷ�Ӧ�����ӷ���ʽΪ_______________________
��3����֪SOCl2��ˮ���ҷ�Ӧ��Һ���ϲ��������������д̼�����ζ���������������AlCl3��Һ���ܵõ���ˮAlCl3��ʹSOCl2��AlCl3��6H2O��ϼ��ȣ��ɵõ���ˮAlCl3���Խ���ԭ��_______________________________________________________
��4)װ��e�в�����Cl2����װ��d��������ϴ��ƿ�������������ƿ����Cl2������һ��ϴ��ƿӦ������Լ���__________
��5������Ӧ������Cl2�����Ϊ896 mL(��ת��Ϊ��״����SO2����)�����õ�������SOCl2 4.76 g����SOCl2�IJ���Ϊ__________��������λ��Ч���֣���
��6�������������õ�SOCl2�м�������NaOH��Һ�������õõ���ɫ��ҺW��������ҺW�д���Cl-�ķ�����________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.����õ���ˮ�е�����ɫʯ����Һ����Һ�ȱ�����ɫ
B.pH��5.6��7֮��Ľ�ˮͨ����Ϊ����
C.�Ͻ��Ӳ��һ��ȳɷֽ����Ĵ�
D.����ڹ����Ĵ�����ȼ�տ�����SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ![]() ��һ������
��һ������![]() ��һ����ﶼ��4�֣������������칹��
��һ����ﶼ��4�֣������������칹��
B. CH3CH=CHCH3�����е��ĸ�̼ԭ����ͬһֱ����
C. ��ϵͳ�������������� ��������2,3,4-����-2-�һ�����
��������2,3,4-����-2-�һ�����
D. ![]() ��
��![]() ������-�������һ�Ϊͬϵ��
������-�������һ�Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǰú̿���ҹ�����Դ������ռ60%���ϣ����ڸ������ṩ������Դ��ͬʱ��ȼ�����ɵ�SO2��NOx��Ҳ����˱Ƚ����صĴ�����Ⱦ���⡣
��1����ȼú�м���CaO��ú����Ԫ�ش������ת��ΪCaSO4����CaO��������SO2�ŷ��������á�
��֪����SO2(g)+CaO(s)=CaSO3(s) ��H=-402kJ��mol-1
��2CaSO3(s)+O2(g)=2CaSO4(s) ��H =-234.2 kJ��mol-1
��CaCO3(s)=CO2(g)+CaO(s) ��H=+178.2 kJ��mol-1
��Ӧ2SO2(g)+O2(g)+2CaO(s)=2CaSO4(s) ��H =____________kJ��mol-1��
��2������̿��NO2�н�ǿ��������������֮��ɷ���2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ��H��Ϊ�о��¶ȡ�ѹǿ���ⲿ���ضԸ÷�Ӧ��Ӱ����ij����С�����ܱ������м���2molNO2�������Ļ���̿����������ʵ��̽����
N2(g)+2CO2(g) ��H��Ϊ�о��¶ȡ�ѹǿ���ⲿ���ضԸ÷�Ӧ��Ӱ����ij����С�����ܱ������м���2molNO2�������Ļ���̿����������ʵ��̽����
i.�̶��ܱ����������Ϊ5L����ú���ʱ��ͬ�¶���NO2��ת����(��)��ʱ��(t)�Ĺ�ϵ��ͼ1��ʾ��
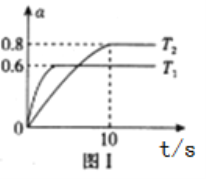
���÷�Ӧ����H_______0����>������<��)���¶�ΪT2ʱ����Ӧ��ʼ���ﵽƽ���ʱ�����v(N2)=__________________
���¶�ΪT1ʱ�÷�Ӧ��ƽ�ⳣ��K=____________________���������¶Ȳ��䣬���NO2ת���ʵķ�����________________________��
��.���������е��¶Ⱥ㶨�����20s����CO2���������(��)��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��
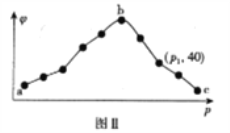
��ͼ�����߳�����������ı仯���ƣ���ԭ��Ϊ____________________________________��ѹǿΪp1ʱ��������c(NO2)��c(N2)=____________________
��3�������£���NaOH��Һ����SO2�ȿ�������������Ⱦ���ֿɻ����Ҫ�Ļ�����Ʒ����ij����Һc(HSO3��)��c(SO32��)=1��100���������ܱ���pH=____________(������K1(H2SO3)=1.5��10-2��K2(H2SO3)=1��10-7)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӱ��ˮ�ĵ���ƽ��,��ʹ��Һ�е�c(H+)>c(OH-)�Ĵ�ʩ�ǣ� ��
A. ��ˮ��ͨ��SO2 B. ��ˮ�������
C. ��ˮ��Ͷ��һС������� D. ��ˮ�м���NaCl
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com