
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用氯气.
I.工业上通常采用电解法制氯气:观察下图,回答:

(1)电解反应的化学方程式为____________________。
(2)饱和食盐水通电后,b端产生的气体检验方法是____________。
II. 实验室用NaOH固体配制100 mL 1.0 mol·L-1的NaOH溶液,试回答下列各题:
(3)需要用托盘天平称量_______g NaOH固体;
(4)实验室有下列仪器:①漏斗 ②200mL容量瓶 ③烧杯 ④玻璃棒 ⑤药匙 ⑥托盘天平 ⑦冷凝。若要实施溶液配制,尚缺的玻璃仪器是___________、________;
(5)容量瓶在使用前必须先____________;
(6)配制过程有以下操作: ①称量 ②移液 ③冷却 ④洗涤 ⑤定容 ⑥溶解 ⑦摇匀 其正确的操作顺序应是:① →_________→________ →________ →________→________→ ⑦
(7)下列五项操作中会导致所得溶液浓度偏低的有____________(填序号);
①没有洗涤烧杯内壁和玻璃棒
②未冷却到室温就将溶液转移到容量瓶并定容
③在转移过程中有溶液撒在外面
④定容时观察液面时俯视
⑤定容后,把容量瓶反复摇匀后发现液面低于刻度线,便滴加几滴水至刻度处
【答案】2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口出,若试纸变蓝,则说明产生的气体为Cl2 4.0 100mL容量瓶 胶头滴管 检查容量瓶是否完好以及瓶塞处是否漏水或检漏 ⑥ ③ ② ④ ⑤ ①③⑤
2NaOH+H2↑+Cl2↑ 移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口出,若试纸变蓝,则说明产生的气体为Cl2 4.0 100mL容量瓶 胶头滴管 检查容量瓶是否完好以及瓶塞处是否漏水或检漏 ⑥ ③ ② ④ ⑤ ①③⑤
【解析】
(1)在工业上用电解饱和食盐水的方法制取氯气;
(2)电解时与电源正极连接的电极为阳极,阳极发生氧化反应,与电源负极连接的电极为阴极,阴极发生还原反应。根据Cl2与KI发生置换反应,I2遇淀粉溶液变为蓝色检验Cl2。
(3)根据n=c·V及m=n·M计算NaOH的质量;
(4)依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
(5)根据容量瓶的作用及溶液特点分析;
(6)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,据此排序;
(7)分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析。
进行误差分析。
I.(1)电解饱和食盐水的方法制取氯气,反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(2)根据图示可知,b端连接电源的正极,为阳极,在阳极,溶液中的阴离子放电。由于阴离子的放电能力Cl->OH-,所以b端发生反应2Cl--2e-=Cl2↑;b端产生的气体是Cl2,该物质具有强的氧化性,与KI在溶液中发生反应:Cl2+2KI=2KCl+I2,I2遇淀粉溶液变为蓝色,所以检验Cl2方法是移走烧杯,将湿润的淀粉碘化钾试纸放在b导气管口处,若试纸变蓝,则说明产生的气体为Cl2。
(3)要配制100 mL 1.0 mol/L的NaOH溶液,根据n=c·V可知:n(NaOH)=1.0mol/L×0.1L=0.1mol,则需要称量NaOH的质量m=n·M=0.1mol×40g/mol=4.0g;
(4)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,需要使用的仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、一定规格的容量瓶、胶头滴管,配制100mL1.0mol/L的NaOH溶液,应选择100mL容量瓶,所以还缺少的仪器:100mL容量瓶、胶头滴管;
(5)容量瓶是准确配制一定体积一定物质的量浓度溶液的仪器,由于溶液检验均一性,溶液各处的浓度相同,在配制溶液时要摇匀溶液,所以在使用前必须先检查容量瓶是否完好以及瓶塞处是否漏水或检漏;
(6)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以其正确的操作顺序应是①⑥③②④⑤⑦;
(7)①没有洗涤烧杯内壁和玻璃棒,使溶质的质量减少,n减小,则c偏低,①符合题意;
②未冷却到室温就将溶液转移到容量瓶并定容,等溶液恢复至室温后,液面低于刻度线,V偏小,则溶液浓度偏高,②不符合题意;
③在转移过程中有溶液撒在外面,使n偏少,则导致配制的溶液浓度偏低,③符合题意;
④定容时观察液面时俯视,则V偏小,使物质的量浓度偏高,④不符合题意;
⑤定容后,把容量瓶反复摇匀后发现液面低于刻度线,便滴加几滴水至刻度处,对溶液进行了稀释,使溶液浓度偏低,⑤符合题意;
故正确选项是①③⑤。


科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为 M 的气态化合物 V L(标准状况),溶于 m g 水中,得到质量分数为 w、物质的量浓度为 c mol/L、密度为 ρg/mL 的溶液,下列说法正确的是
A.相对分子质量![]() B.物质的量浓度
B.物质的量浓度![]()
C.溶液的质量分数![]() D.溶液密度
D.溶液密度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A. 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
C. 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D. a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
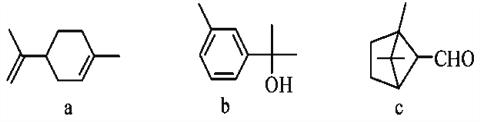
A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向仅含SO![]() 、I-、Br-且物质的量分别为m、n、6 mol 的钠盐溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )
、I-、Br-且物质的量分别为m、n、6 mol 的钠盐溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )

A. 曲线Ⅱ代表Br-的变化情况
B. 曲线Ⅰ对应的反应:SO![]() +Cl2+H2O===2H++SO
+Cl2+H2O===2H++SO![]() +2Cl-
+2Cl-
C. 通入的氯气为5 mol时,溶液中的主要阴离子为Cl-、SO![]()
D. 溶液中n(Na+)=n(SO![]() )+n(I-)+n(Br-)
)+n(I-)+n(Br-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为___。
(二)A、X、Y、Z、W、M、G等原子序数一次增大的前四周期元素
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)画出W基态原子的核外电子排布图______。
(2)A2Y的VSEPR模型名称为____。
(3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理,写出X2Y的电子式____。
(4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。
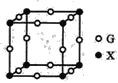
(5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为_____cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com