
| A. | Mg2+ 1s22s22p6 | B. | Br 1s22s22p63s23p63d104s24p5 | ||
| C. | O2- 1s22s22p6 | D. | Cr ls22s22p63s23p63d44s2 |
分析 原子核外电子排布应符合构造原理、能量最低原理、洪特规则和泡利不相容原理,一般来说离子的核外最外层达到8电子稳定结构,根据构造原理,s能级最多可容纳2个电子,p能级有3个轨道最多可容纳6个电子,电子总是优先从能量低的能层、能级排列,其中s2是原子得两个电子形成的稳定的结构,所以第三能层中的电子排布最多应为3s23p6,据此分析解答.
解答 解:A.Mg的原子序数为12,离子的核外电子排布式为1s22s22p6,故A正确;
B.35号Br电子排布式为:1s22s22p63s23p63d104s24p5,故B正确;
C.O原子核外有8个电子,O2-核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故C正确;
D.Cr的d能级处于半满时稳定,因此核外电子排布式为1s22s22p63s23p63d54s1,故D错误;
故选D.
点评 本题考查了原子或离子核外电子排布,明确排布规律及其规则是解本题关键,为考试热点,知道每个能级最多排列的电子数,要遵循构造原理,题目难度不大.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{a-3}{12}$mol | B. | $\frac{a-27}{12}$mol | C. | $\frac{a-81}{18}$mol | D. | $\frac{a-9}{18}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
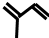 .请回答下列问题:
.请回答下列问题: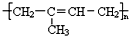 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
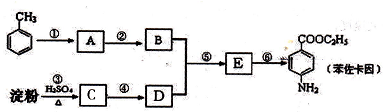
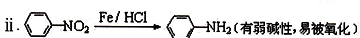
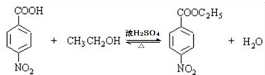 .
.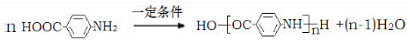
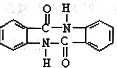 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图: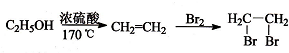
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
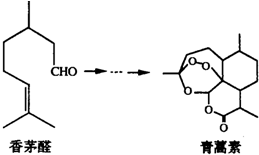
| A. | 青蒿素易溶于水,更易溶于乙醇等有机溶剂中 | |
| B. | 向香茅醛中滴加溴水后溴水褪色,证明香茅醛中含有碳碳双键 | |
| C. | 香茅醛与青蒿素均能发生氧化、取代、加成、聚合反应 | |
| D. | 香茅醛的同系物中,含4个碳原子的有机物有3种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V=336 mL时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| B. | V=448 mL时,2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)] | |
| C. | V=672 mL时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) | |
| D. | 通入CO2过程中恒有关系式:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
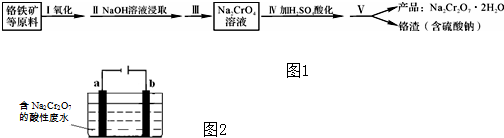
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
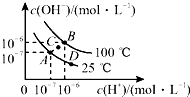
| A. | 图中A、B、D三点处Kw的大小关系:B>A>D | |
| B. | 若处在B点,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显中性 | |
| C. | 25℃时,保持温度不变,在水中加入适量NH4Cl固体,体系可从A点变化到C点 | |
| D. | A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com