
A、
| ||
B、
| ||
C、
| ||
D、
|
| m |
| M |
| n |
| V |
| mg |
| 23g/mol |
| m |
| 23 |
| m |
| 23 |
| 1 |
| 2 |
| m |
| 46 |
| ||
| VL |
| m |
| 46V |
| ||
| 0.05L |
| m |
| 230V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、冬天食物难以腐败 |
| B、用过量O2与SO2混合制SO3 |
| C、将盛NO2的瓶子放入冰水中,颜色变浅 |
| D、工业上制NH3时产用高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热才能发生的反应一定是吸热反应 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ?mol-1 |
| C、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
| D、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O |
| B、CaCO3+2HCl=CaCl2+CO2↑+H2O |
| C、2HCl+Zn=ZnCl2+H2↑ |
| D、2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 mL pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,则所得溶液体积V(总)=20 mL |
| B、Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol/L |
| D、pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
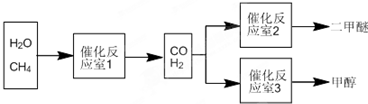
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlON和石英的化学键类型相同 |
| B、AlON和石英晶体类型相同 |
| C、AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同 |
| D、AlON和(工业上通过电解法制备铝用的)Al2O3晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com