
(18分)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用研究。
(1)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是___ _(填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,
一定条件下发生反应:CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H=-49.0 kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

的转化率= ;能使平衡体系中n(CH3OH)增大的措施有 。
(2)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
己知:①CH4(g)+2O2(g)=CO2(g)+2H2O( l ) △H=-890.3kJ/mol
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
(3)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。当电子转移的物质的量为________时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
溶解度(s)/g | 溶度积(Ksp) | ||
Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
吸收CO2最合适的试剂是__ __(填“Ca(OH)2”或“Ba(OH)2”)溶液。
(1)① B;② 平衡常数表达式K= ;v(H2)=0.225 mol/(L·min); 75%;降低温度或加压或增大H2的量等;
;v(H2)=0.225 mol/(L·min); 75%;降低温度或加压或增大H2的量等;
(2)CO2(g) + 4H2(g) ==CH4(g)+ 2H2O(l) ΔH=-253.9kJ/mol
(3)CH3OH-6e-+8OH-= CO32-+6H2O; 1.2mol ;(4)Ba(OH)2 。
【解析】
试题分析:(1)如将CO2与H2以1:3的体积比混合。①适当条件下合成某烃和水,根据质量守恒定律可得:2CO2+6H2=C2H4+4H2O所以该烃是烯烃,选项是B;②反应CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)的平衡表达式是K= 。v(H2) :V(CO2)=3:1, V(CO2)=0.75mol/L÷10min=0.075mol/(L·min),所以v(H2) =3 V(CO2)= 3×0.075mol/(L·min)= 0.225 mol/(L·min);从反应开始至平衡,CO2改变浓度是0.75mol/L,则H2改变浓度是2.25mol/L,所以氢气的转化率=(2.25mol/L÷3mol/L)×100%=75%;若使平衡体系中n(CH3OH)增大,则应该使平衡正向移动。根据平衡移动原理,可知采取的措施有降低温度或加压或增大H2的量等;(2)②×2—①,整理可得:CO2(g) + 4H2(g) ==CH4(g)+ 2H2O(l) ΔH=-253.9kJ/mol;(3)以氢氧化钾为电解质的甲醇燃料电池中,通入甲醇的电极是负极,负极反应式是CH3OH-6e-+8OH-= CO32-+6H2O; n(O2)= 6.72L÷22.4L/mol=0.3mol。由于在氧化还原反应中电子转移数目相等。所以n(e-)=0.3mol×4=1.2mol。(4)由于CaCO3 、BaCO3的溶度积常数相差不大,而物质的溶解度:Ca(OH)2的溶解度小于Ba(OH)2,所以吸收CO2最合适的试剂是Ba(OH)2溶液。
。v(H2) :V(CO2)=3:1, V(CO2)=0.75mol/L÷10min=0.075mol/(L·min),所以v(H2) =3 V(CO2)= 3×0.075mol/(L·min)= 0.225 mol/(L·min);从反应开始至平衡,CO2改变浓度是0.75mol/L,则H2改变浓度是2.25mol/L,所以氢气的转化率=(2.25mol/L÷3mol/L)×100%=75%;若使平衡体系中n(CH3OH)增大,则应该使平衡正向移动。根据平衡移动原理,可知采取的措施有降低温度或加压或增大H2的量等;(2)②×2—①,整理可得:CO2(g) + 4H2(g) ==CH4(g)+ 2H2O(l) ΔH=-253.9kJ/mol;(3)以氢氧化钾为电解质的甲醇燃料电池中,通入甲醇的电极是负极,负极反应式是CH3OH-6e-+8OH-= CO32-+6H2O; n(O2)= 6.72L÷22.4L/mol=0.3mol。由于在氧化还原反应中电子转移数目相等。所以n(e-)=0.3mol×4=1.2mol。(4)由于CaCO3 、BaCO3的溶度积常数相差不大,而物质的溶解度:Ca(OH)2的溶解度小于Ba(OH)2,所以吸收CO2最合适的试剂是Ba(OH)2溶液。
考点:考查物质的火车产物、化学平衡常数的表达式、化学反应速率和物质的转化率的计算、热化学方程式的书写、燃料电池的反应原理、电子转移及气体吸收试剂的选择的知识。


科目:高中化学 来源:2014-2015福建省高二上学期期中化学(文)试卷(解析版) 题型:选择题
酸雨是指:
A.酸性的雨 B.pH=5.6的雨
C.pH<5.6的雨 D.pH=5的雨
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市高三第一次诊断性检测理综化学试卷(解析版) 题型:选择题
若NA为阿伏加德罗常数的值。参阅表中数据,下列判断在标准状况下正确的是
℃ | NO2 | HF |
熔点 | —11.2 | —83.6 |
沸点 | 21.0 | 19.52 |
A.20. 0 gHF中含σ键数目为1.0NA
B.将22.4LNH3溶于1L水中,溶液含有OH-数目为0.1NA
C.6.72 LNO2与水反应后,转移的电子数为0.2NA
D.H2S和SO2各0.l mol反应后,体系中的S原子数目小于0.2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
关于下列各图的叙述正确的是
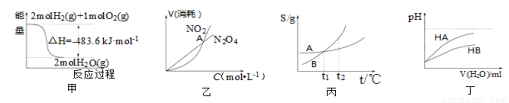
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,Y与M形成的气态化合物在标况下的密度为0.76g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.由X、Y、Z、M四种元素形成的化合物一定有共价键
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质一定是原子晶体
D.XZ2、X2M2、W2Z2均为直线型的共价化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津南开区高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
下列实验设计和结论相符的是
A、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B、某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C、用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32-
D、用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,可知原溶液中有Na+无K+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:填空题
(15分)A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示。X位于元素周期表中第四周期ⅠB族。请回答下列问题:

(1)D单质晶体中原子的堆积方式为体心立方堆积,其配位数是 。DAB3中阴离子的立体构型是 。中学化学常见微粒中,与晶体D3AB4中阴离子互为等电子体的分子有 (任写一种)。
(2)X2+离子的电子排布式为______,X2+离子与水分子形成的配离子[X(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[X(H2O)2(Cl)2]具有极性的分子的结构__________。
(3)A元素分别能与硼、铝形成相同类型的晶体,但是A与硼形成晶体的熔点更高,其原因是 。
(4)AC3的沸点比氨的沸点低得多,原因是 。
(5)若E与C形成的晶体的密度为a g·cm-3,则晶胞的体积是_____ cm3 (用NA表示阿伏伽德罗常数的值,写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:选择题
下列物质分类正确的是
A.Cl2O和NO2均是酸性氧化物 B.水玻璃和氨水均是混合物
C.烧碱和三氧化硫均为电解质 D.牛奶和氯化铝溶液均为胶体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
如图:甲为直流电源,乙为用含有酚酞的饱和食盐水浸透的滤纸,丙为电镀槽。断开K后,发现乙上c点附近显红色;闭合K,可实现铁上镀锌,电路中通过0.002NA个电子。以下判断正确的是
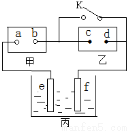
A.a为正极
B.d上发生还原反应
C.e为锌板
D.f的质量增加0.056 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com