
��1����֪2H2��g��+O2��g��=2H2O��l����H����571.6 kJ/mol��
CO��g����1/2O2��g����CO2��g����H����283.0 kJ/mol��ijH2��CO�Ļ��������ȫȼ��ʱ�ų�113.74 kJ������ͬʱ����3.6 gҺ̬ˮ����ԭ���������H2��CO�����ʵ���֮��Ϊ___________��
��2���Լ״�������������������ҺΪԭ�ϣ�ʯīΪ�缫���ɹ���ȼ�ϵ�أ���֪��ȼ�ϵ�ص��ܷ�Ӧʽ�ǣ�2CH3OH +3O2+4OH-=2CO32-+6H2O����ȼ�ϵ�ط�����Ӧʱ����������Һ��PH__________ (����� ����С�� ���䡱)�õ�صĸ�����ӦʽΪ_________________��
��3�� ������ȼ�ϵ�ؽ��д�ͭ�ľ�������ͭӦ���ӵ�Դ��________�����ô�ͭ�������ص�������ӦʽΪ_________________��
��1��1��1......2��
��2������.1�� CH3OH -6e����8OH-��1����CO32-��6H2O ....2��
��3������..1�֡� Cu2+ + 2e- =Cu��.2��
��������������⣺ˮ�����ʵ���Ϊ=0.2mol����2H2+O2�T2H2O��֪��n��H2��=n��H2O��=0.2mol����2H2��g��+O2��g���T2H2O��l����H=-571.6kJ?mol-1��֪��0.2molH2ȼ�շų�������Ϊ57.16KJ����COȼ�շų�������Ϊ113.74KJ-57.16KJ=56.58KJ������������CO�����ʵ���Ϊx����
CO��g��+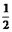 O2��g��=CO2��g����H=-283kJ?mol-1
O2��g��=CO2��g����H=-283kJ?mol-1
1 283KJ
X 56.58KJ
���x=0.2mol����n��CO��=0.20mol����ԭ���������H2��CO�����ʵ���֮��Ϊ1:1.��2���Լ״�������������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�أ�������ӦΪ��3O2+12H2O+12e-=12OH-���ܷ�ӦʽΪ��2CH3OH+3O2+4OH-=2CO32-+6H2O����ʽ�����������ӦΪ��2CH3OH-12e-+16OH-=2CO32-+12H2O����3���͵�Դ�����������ĵ缫����������ⷽ��������ͭ�����ص����������Ǵ�ͭ���缫��ӦΪ��Cu-2e-=Cu2+
���㣺�йط�Ӧ�ȵļ��㣻�ø�˹���ɽ����йط�Ӧ�ȵļ��� ��ѧ��Դ���͵��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ú��Ϊȼ�Ͽ�ͨ����������;����
;��I��C(s) +O2 (g)=CO2(g) ��H1<0 ��
;��II�����Ƴ�ˮú����C(s) +H2O(g)=CO(g)+H2(g) ��H2>0 ��
��ȼ��ˮú����2CO(g)+O2 (g)=2CO2(g) ��H3<0 ��
2H2(g)+O2 (g)=2H2O(g) ��H4<0 ��
��ش��������⣺
��1��;��I�ų������� ( ����ڡ������ڡ���С�ڡ�) ;��II�ų���������ԭ���� ��
��2����H1����H2����H3����H4����ѧ��ϵʽ�� ��
��3��12g̿���������в���ȫȼ������һ����̼���ų�110.35kJ���������Ȼ�ѧ����ʽΪ ��
��4��ú̿��Ϊȼ�ϲ���;��II���ŵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ݱ�����һ���������ɶ�����̼�������ϳ��Ҵ��ѳ�Ϊ��ʵ��
��֪����CH3CH2OH(l)+3 O2 (g)=2CO2(g)+3H2O(l) ��H="-1366.8" kJ/mol
��2H2 (g)+O2 (g)=2H2O(l) ��H="-571.6" kJ/mol
��1��д����CO2��H2 ��Ӧ�ϳ�CH3CH2OH (l)��H2O(l)���Ȼ�ѧ����ʽ ��
��2�������Ҵ�ȼ�ϵ���״��棬���ƹ㣬�Ի�����ȾС�����зdz������ķ�չǰ������ȼ�ϵ���У�ʹ�ò����缫��KOH��Һ���������Һ��ͨ���Ҵ�ȼ����һ��Ϊ �����ü��ϵĵ缫��ӦʽΪ ��
��3�����Ҵ�ȼ�ϵ�ص��400 mL ����ʳ��ˮװ�ÿɼ�ʾ����ͼ��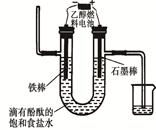
��װ���з�����ⷴӦ�ķ���ʽΪ �������������۲쵽�������� ������������448 mL���壨����ڱ�״���²�ã�ʱ��ֹͣ��⣬���������Һ��Ͼ��ȣ���Һ��pHΪ ����������������ܽ⼰��Һ����ı仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����״���ԭ��CO��H2�������з�Ӧ��ȡ��CH4��g��+H2O��g�� CO��g��+3H2��g�����Իش��������⡣
CO��g��+3H2��g�����Իش��������⡣
��1����֪���� CH4��g��+3/2 O2��g�� CO��g��+2H2O��g����Hl��
CO��g��+2H2O��g����Hl��
�� H2��g��+1/2 O2��g�� H2O��g�� ��H2��
H2O��g�� ��H2��
��CH4��g��+ H2O��g�� CO��g��+3H2��g���ġ�H��____ ���ú���H1����H2��ʽ�ӱ�ʾ��
CO��g��+3H2��g���ġ�H��____ ���ú���H1����H2��ʽ�ӱ�ʾ��
��2��һ�������·�ӦCH4��g��+H2O��g�� CO��g��+3H2��g����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ����T2>T1�� ��������Ӧ�ġ�H____ 0���<������>������=������ͬ����A��B����Ӧƽ�ⳣ����KA��KB���Ĵ�С��ϵΪKA____ KB
CO��g��+3H2��g����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ����T2>T1�� ��������Ӧ�ġ�H____ 0���<������>������=������ͬ����A��B����Ӧƽ�ⳣ����KA��KB���Ĵ�С��ϵΪKA____ KB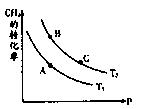
��3��ά���¶�T2����0.04 mol CH4��0.04mol H2O��g��ͨ���ݻ�Ϊ1L�Ķ����ܱ������з�����Ӧ��ƽ��ʱ�ﵽB�㣬���CH4��ת����Ϊ50%,�÷�Ӧ�ڴ��¶��µ�ƽ�ⳣ��KB=____ ������������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����_ ___
a��������CH4��H2O��CO��H2�����ʵ���֮��Ϊ1��1��1��3
b���������ܶȺ㶨
c��������ѹǿ�㶨
d��3������CO������������H2��
��4��������B��ƽ������ϣ�����������ͨ��amol CH4��a mol H2O���壬ʹ֮��C�����´�ƽ�⣬��ʱ���CO��0.03mol����a=____ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪���Ϊ2L�ĺ����ܱ������з�����Ӧ��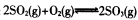 ������ݻ�ѧ��Ӧ���й�ԭ��ͬ����������
������ݻ�ѧ��Ӧ���й�ԭ��ͬ����������
��1��һ�������£�����2 mol SO2��g����2 mol O2��g����20 s���SO2������ٷֺ���Ϊ12��5%������SO2��ʾ�÷�Ӧ����20s�ڵķ�Ӧ����Ϊ____����ʱ�����ܱ������ڻ�������ѹǿ�Ƿ�Ӧǰ��____����
��2���������������Ϊ�жϣ�1���п��淴Ӧ�ﵽƽ��״̬���ݵ��ǣ�����ţ�____��
��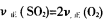
�ڻ��������ܶȲ���
�ۻ�������ƽ����Է�����������
�ܸ������Ũ�ȶ����ٷ����仯
��3����ͼ��ʾ�÷�Ӧ�����ʣ�v����ʱ�䣨t���ı仯�Ĺ�ϵ�������в�ͬʱ����У�SO3�İٷֺ�����ߵ��ǣ� ��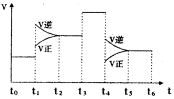

��ͼ����������Ϊt3ʱ�ı��������������� ��
t6ʱ���������������ϵ�г�������SO3���ٴ�ƽ���
SO2������ٷֺ�����t6ʱ �����\��С�����ڡ�����
��4����ͼ��P�ǿ�����ƽ�л����Ļ���������ͬ�¶�ʱ����A�����г���4 mol SO3��g�����ر�K����B�����г���2 mol SO3��g�����������ֱ�����Ӧ��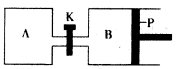
��֪��ʼʱ����A��B�������ΪaL���Իش�
�ٷ�Ӧ�ﵽƽ��ʱ����B�����Ϊ1��2a L������B��SO3ת
����Ϊ____
������K��һ��ʱ������´ﵽƽ�⣬����B�����Ϊ __L����ͨ��������������Բ��ƣ��Ҳ������¶ȵ�Ӱ�죩��
��5����֪�������ȼ����Ϊ��H=-296kJ/mol�����ⶨ��S��s������120gSO3��g���ɷ���592��5kJ����д��SO2��g����������SO3��g�����Ȼ�ѧ����ʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��Ӧ�仯���̼�������о�����Ҫ��ش����⣺
��1�����ڷ�Ӧ�����������仯���о���
��2CO��g��+O2��g��=2CO2��g����H= kJ��mol-1��
��2�����ڷ�Ӧ���ʺ��ȵ��о���
��ҵ�������ص�ԭ������NH3��CO2Ϊԭ�Ϻϳ�����[CO(NH2)2]����Ӧ�Ļ�ѧ����ʽΪ��
2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ����K�����¶ȣ�T / �棩��ϵ���£�
CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ����K�����¶ȣ�T / �棩��ϵ���£�
| T / �� | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
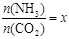 ����ͼ��1���ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��
����ͼ��1���ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ���� ��

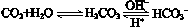 ��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��c(HCO3-)��c(H2CO3)�仯��ϵ���±���
��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��c(HCO3-)��c(H2CO3)�仯��ϵ���±���| c(HCO3-)��c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����ƽ�ⳣ������Ka��ʾ)�Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
| ��ѧʽ | HF | H2CO3 | HClO |
| ����ƽ�ⳣ�� ��Ka�� | 7.2��10-4 | K1=4.4��10-7 K2=4.7��10-11 | 3.0��10-8 |
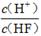 D��
D��
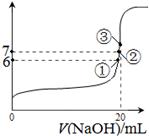
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������һ����ࡢ��Ч��������Դ��
I.�ü�����ȡ�����ķ�Ӧ��Ϊ�������������仯����ͼ��ʾ��
��1�������ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ�� ��
II.���ݻ�Ϊ1L���ܱ������ڣ�����0.1molCO��0.1molH2O���ڴ������ڵ������¸��¼���ʹ�䷴Ӧ�����CO2��Ũ����ʱ��仯��ͼ����ͼ��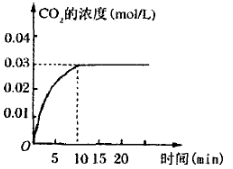
��2���ڸ��¶��£��ӷ�Ӧ��ʼ���ﵽƽ��ʱ��CO��ƽ����Ӧ����Ϊ ��
��3�����¶��£��˷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ�������÷�����ʾ�� ��
��4�����иı��У���ʹƽ��������Ӧ�����ƶ����� ��
| A�������¶� | B������ѹǿ |
| C������H2O��g����Ũ�� | D������CO2��g����Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�о�CO2��CH4����Ӧʹ֮ת��ΪCO��H2���Լ���ȼ��Σ������С����ЧӦ������Ҫ�����塣
��1����֪��2CO��g��+O2��g����2CO2��g�� ��H����566kJ/mol
2H2��g��+O2��g����2H2O��g�� ��H����484kJ/mol
CH4��g��+2O2��g����CO2��g��+2H2O��g�� ��H����890kJ/mol
��CH4��g��+CO2��g����2CO��g��+2H2��g����H��____________��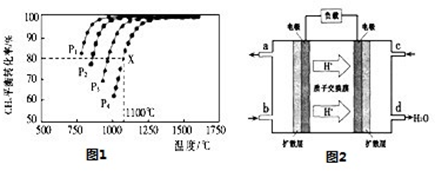
(2)���ܱ�������ͨ�����ʵ���Ũ�Ⱦ�Ϊ0.1mol/L��CH4��CO2����һ�������·�����ӦCH4��g��+CO2��g����2CO��g��+2H2��g�������CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ1��
��������ʵ��˵���÷�Ӧһ���ﵽƽ����� ��
a��CO2��Ũ�Ȳ��ٷ����仯
b��������CH4����2������CO��
c����������ƽ����Է��������������仯
d��CO��H2�����ʵ�����Ϊ1:1
�ھ�ͼ��֪��P1��P2��P3��P4�ɴ�С��˳��Ϊ ��
����ѹǿΪP4��1100��������£��÷�Ӧ5minʱ�ﵽƽ��x�㣬����CO��ʾ�÷�Ӧ������Ϊ �����¶��£���Ӧ��ƽ�ⳣ��Ϊ ��
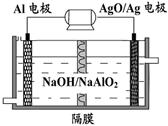
(3)��CO��H2�ɺϳɼ״�(CH3OH)���Լ״���������Ӧ�Ƴɵ�ȼ�ϵ����ͼ2��ʾ���õ�ع�������O2Ӧ�� (�c��һb��)��ͨ�ˣ���ظ�����ӦʽΪ �����øõ�ص�⾫��ͭ��ÿ�õ�6. 4gͭ��ת�Ƶ�����ĿΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com