
下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(T)变化的曲线(已知草酸锰不稳定,但其中锰元素的化合价在300 ℃以下不变)。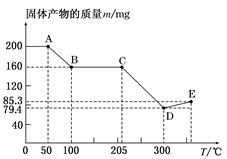
试回答下列问题:
(1)写出B点固体产物的化学式:_________________________________________。
(2)从B点到C点过程中固体物质质量不变的原因是_____________________________________________________。
(3)通过计算确定D点产物的相对分子质量,并推断其合理的化学式:____________
(4)从D点到E点过程中固体物质质量增加的原因是___________________________
科目:高中化学 来源: 题型:填空题
将CO2通入NaOH溶液中,所得产物随通入的CO2的物质的量的不同而不同。完成下列填空。
(1)250 mL 1 mol/L的NaOH溶液,最多可吸收CO2 L(标准状况下)。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,将所得溶液蒸干,计算所得固体中各成分的物质的量。
向未知浓度、体积为V L的 NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体。
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1 g 白色沉淀。
①根据以上数据,用代数式表示CO2的体积V(CO2)= 。
②根据以上数据,推理计算出NaOH溶液的浓度范围。
(4)写出确定NaOH浓度的实验步骤,并用代数式表示NaOH溶液的浓度。(设计实验方案时,只能用题中提供的CO2和NaOH溶液,不得使用其它化学试剂。)
实验步骤: 。c(NaOH)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
标准状况下336 L的NH3溶于1 L水中,所得溶液的质量分数为________,若该溶液的密度为a g/cm3,则物质的量浓度为________。将上述氨水全部转化为NH4Cl,所需4 mol·L-1的盐酸的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化氢溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的问题:
(1)下述反应中,H2O2仅体现氧化性的反应是 (填代号)。
A.Na2O2+2HCl 2NaCl+H2O2 2NaCl+H2O2 |
B.Ag2O+H2O2 2Ag+O2↑+H2O 2Ag+O2↑+H2O |
C.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
D.3H2O2+Cr2(SO4)3+10KOH 2K2CrO4+3K2SO4+8H2O 2K2CrO4+3K2SO4+8H2O |

 A+NH3↑,试指出生成物A的化学式为 。
A+NH3↑,试指出生成物A的化学式为 。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
无机化合物A中含有金属Li元素,遇水强烈水解,主要用于有机合成和药物制造,是具有良好前景的储氢材料。在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况)。已知气体C极易溶于水得到碱性溶液, 电解无水B可生成金属单质D和氯气。
回答下列问题:
(1)A的化学式是 , C的电子式是 。
(2)写出化合物A与盐酸反应的化学方程式: 。
(3)某同学通过查阅资料得知物质A的性质:
Ⅰ.工业上可用金属D与液态的C在硝酸铁催化下反应来制备A物质,纯净的A物质为白色固体,但制得的粗品往往是灰色的。
Ⅱ.物质A熔点390℃,沸点430℃,密度大于苯或甲苯,不溶于煤油,遇水反应剧烈,也要避免接触酸和酒精。在空气中化合物A缓慢分解,对其加强热则猛烈分解,但不会爆炸.在750~800℃分解为化合物E和气体C。
①物质A在750~800℃分解的方程式为: 。
②久置的物质A可能大部分变质而不能使用,需将其销毁。遇到这种情况,可用苯或甲苯将其覆盖,然后缓慢加入用苯或甲苯稀释过的无水乙醇,试解释其化学原理 。
(4)工业制备单质D的流程图如下:
①步骤①中操作名称: 。
②试用平衡原理解释步骤②中减压的目的: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________ mol·L-1。
(2)该同学取100 mL该“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是________。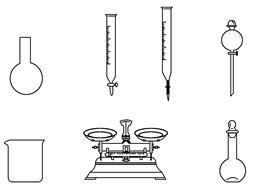
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是________。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
闪锌矿(主要成份为ZnS)是含锌主要矿物之一,空气中高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。回答下列问题(以下计算保留2位小数)
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留
固体的质量为1.32 g,样品中含硫化锌的质量分数是_________。
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(反应中只生成一种还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液中和余酸,耗用NaOH溶液的体积为21.70 mL。
①反应后溶液中多余的硫酸是____________ mol。
②通过计算确定浓硫酸被还原的产物是________________________。
(3)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:
(1)原混合物中Na2SO4的物质的量浓度为 mol?L-1;
(2)在标准状况下产生气体的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)3.01×1022个OH- 的物质的量为________,质量为________,含有质子的物质的量为________,含有电子的物质的量为________。
(2)相同状况下,10mL X2气体与30mL Y2气体化合生成20mL C气体,则C的化学式为_________。
(3)某地酸雨经检验,除含氢离子外,还有如下离子:c(Na+)=1.4×10-3 mol·L-1 ,
c(Cl- ) =3.5×10-3 mol·L-1,c(NH4+) =2.3×10-3 mol·L-1, c(SO42-) =1.5×10-3
mol·L-1。则该溶液中氢离子的浓度为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com