
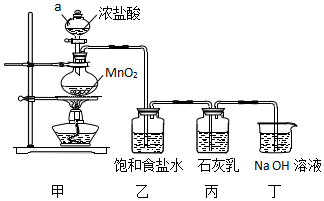
分析 模拟工业制漂白粉:装置A制取Cl2,a为分液漏斗,可以控制加入的浓盐酸,圆底烧瓶中盛放二氧化锰,反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,HCl易挥发,制得的氯气中含有氯化氢,可以用食盐水来除杂,乙装置除去氯气中的氯化氢,丙装置Cl2与Ca(OH)2的反应制漂白粉,Cl2有毒,需进行尾气处理,装置丁吸收多余的氯气.
(1)根据仪器的特征以及常见仪器的名称解答;MnO2与浓盐酸反应生成氯化镁、氯气与水,MnO2是氧化剂;
(2)HCl易挥发,制得的氯气中含有氯化氢,可以用食盐水来除杂;
(3)①漂白粉的主要成分是次氯酸钙[Ca(ClO)2]和氯化钙,氯气与石灰乳反应产物是氯化钙、次氯酸钙和水;
②根据氯气和碱反应放出热量,温度稍高即发生副反应6Cl2+6Ca(OH)2═5CaCl2+Ca(ClO3)2+6H2O进行判断;
③因为温度高时易生成Ca(ClO3)2,所以避免此反应发生可以采取降温措施或控制反应避免反应放热瞬时升高;
(4)漂白粉有效成分为次氯酸钙,能够与空气中的二氧化碳反应而导致变质.
解答 解:(1)甲装置中仪器a具有球形特征,有玻璃活塞,在该实验中,可以控制加入的浓盐酸,为分液漏斗,装置A制取Cl2,反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中,MnO2中Mn元素化合价降低(+4→+2),MnO2为氧化剂,
故答案为:分液漏斗;作氧化剂;
(2)浓盐酸和二氧化锰反应过程中会发出氯化氢气体,氯化氢在氯化钠饱和溶液中易溶,而氯气难溶,通过饱和食盐水的作用是除去Cl2中混有的HCl气体,
故答案为:除去氯气中混有的氯化氢;
(3)①漂白粉的主要成分是次氯酸钙[Ca(ClO)2]和氯化钙,将氯气通入石灰乳[Ca(OH)2]制取漂白粉,同时有水生成,反应的化学方程式为:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,
故答案为:2Cl2+2 Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②氯气和碱反应会放出热量,导致温度升高,当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙和水;当温度高时,发生了副反应:6Cl2+6Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$5CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2) 远大于n[Ca(ClO)2],
故答案为:氯气和碱反应会放出热量,导致温度升高,发生了副反应:6Cl2+6Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$5CaCl2+Ca(ClO3)2+6H2O;
③温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,或控制氯气产生速率,通过控制反应速率,避免反应放热瞬时升高,
故答案为:将丙装置浸在盛有冷水的水槽中或控制氯气产生速率;
(4)漂白粉有效成分为次氯酸钙,HClO虽是强氧化性的酸,但它是比碳酸还弱的酸,受空气中的水、CO2作用而导致变质,生成CaCO3和HClO,该反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,所以漂白粉应密封保存,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
点评 本题考查了氯气的制法及化学性质,题目难度中等,掌握氯及其化合物的性质以及流程图各装置的作用是解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
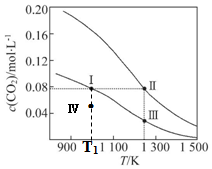
| A. | 该反应的△H>0、△S<0 | B. | 体系的总压强p:p (Ⅰ)>p (Ⅲ) | ||
| C. | 平衡常数:K(Ⅰ)>K (Ⅱ) | D. | T1K时,Ⅳ点所处的状态中 v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛的电子式: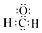 | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: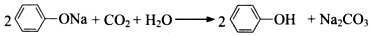 | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L | B. | 5.6L | C. | 8.4L | D. | 14L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将pH=5的HCl 溶液稀释1000倍后pH变为8 | |
| B. | 将pH=8的NaOH溶液稀释1000倍后pH变为6 | |
| C. | 将 pH=2的HCl 溶液加热蒸发,体积变为原来的$\frac{1}{10}$,pH变为1 | |
| D. | 将pH=3的醋酸溶液稀释100倍后,pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入肥皂液产生浑浊的水是硬水 | |
| B. | 软水不一定是纯水 | |
| C. | 硬水中的钙、镁离子通过加热煮沸可以完全沉下 | |
| D. | 硬水加入石灰一纯碱后生成Mg(OH)2和CaCO3沉淀;利用离子交换剂也可把硬水软化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
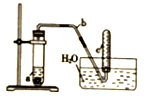 用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.
用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然物质都是绿色无毒的物质 | B. | 只饮用纯净水有益人体健康 | ||
| C. | 禁止吸烟可减少室内空气污染 | D. | 微量元素只能通过保健品摄入 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com