
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.12 g石墨烯(单层石墨)中含C原子个数为NA
B.等质量的C18O与NO含有的原子个数均为2 NA
C.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
D.25℃时1 L pH=13的Ba(OH)2溶液中含有OH一的数目为0.2 NA
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
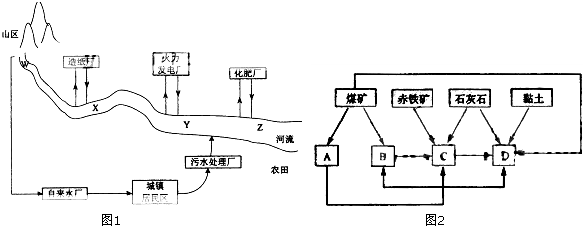
| 地点 项目 | W | X | Y | Z |
| 水温/℃ | 15 | 18 | 26 | 25 |
| pH | 6 | 8 | 5 | 5 |
| 溶解氧量/(mg?L-1) | 11 | 9 | 7 | 3 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和解释都正确的是
选项 | 实验操作 | 现象 | 解释 |
A. | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32? |
B. | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
C. | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 上层呈紫红色,下层有白色沉淀生产 | 铜离子可以氧化碘离子,白色沉淀可能为CuI |
D. | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是(N-14 O-16 C-12 H-1)
A.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
B.标准状况下,22.4 L CH2Cl2中含有的氯原子数目为2NA
C.16g CH4与18 g NH4+ 所含质子数相等
D.1molCu在足量硫蒸气中反应时转移2NA个电子
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
下列实验中,依据实验操作及现象,得出的结论正确的是
| 操 作 | 现 象 | 结 论 |
A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
C | 测定等浓度的Na2CO3和Na2SO4 溶液的pH | 前者pH比后者的大 | 非金属性: |
D | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 CO32-或 HCO3- |
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:填空题
(16分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
物 质 | CH4 | CO2 | CO | H2 |
平衡浓度(mol·L-1) | 0.5 | 0.5 | 2.0 | 2.0 |
① 此温度下,该反应的平衡常数K=________(注明单位).
② 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应: CO2+CH4  CH3COOH, 请回答:
CH3COOH, 请回答:
① 温度与催化剂的催化效率和乙酸的生成速率如图。

250~300℃时,温度升高而乙酸的生成速率降低的原因是____ 。
② 为提高上述反应CH4的转化率,可采取的措施有 (写2种)。
③ Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
① 若寻找吸收CO2的其他物质,下列建议合理的是___。
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
② Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列装置、试剂选用或操作正确的是
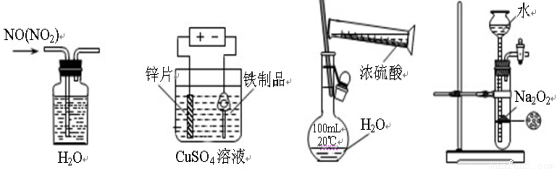
A.除去NO中的NO2 B.铁制品表面镀锌 C.稀释浓硫酸 D.制备少量O2
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(16分)目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方。“达菲”的主要合成原料是我国盛产的莽草酸。从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒。下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构)。
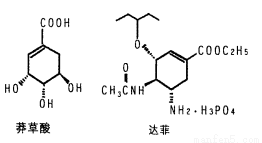
(1)“达菲”的相对分子质量为410.4,扣除H3PO4后的部分称为“自由基奥司他韦”。试求“自由基奥司他韦”的相对分子质量________;“自由基奥司他韦”能与磷酸结合,说明氨基具有________性。
(2)莽草酸中含有的官能团有__________________________(写名称)。
(3)下列有关莽草酸的说法中正确的是____________________________。
①分子式为C7H10O5
②能使FeCl3溶液显紫色
③能使溴的四氯化碳溶液褪色
④l mol莽草酸与分别足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为4:l
(4)莽草酸与C2H5OH发生酯化反应的化学方程式是_________________。
(5)莽草酸在浓硫酸作用下加热可得到B(C7H6O3),B的同分异构体中既含有酚羟基又含有酯基的共有______种,写出其中一种同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
化学知识在生活中有重要意义,下列说法正确的是
A.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
B.乙醇、乙酸和甲醛广泛应用于食品加工
C.计算机芯片所用的材料是高纯度的二氧化硅
D.捕获工业排放的CO2能降低地球的温室效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com