

分析 (1)铁粉过量,铁离子和铜离子都与铁反应,据此写出反应的离子方程式;
(2)根据n=$\frac{m}{M}$计算出铜的物质的量,再根据反应反应2Fe3++Cu=Cu2++2Fe2+计算出消耗铁离子的物质的量,从而得出消耗铁离子的浓度,最后计算出腐蚀后残夜中铁离子浓度;计算出刻蚀后残液中亚铁离子、铁离子和铜离子的物质的量,再计算出加入过量铁粉后的滤液中含有亚铁离子的总物质的量,结合质量守恒定律计算出通入氯气后新的刻蚀液中铁离子的物质的量,再根据c=$\frac{n}{V}$计算出铁离子浓度.
解答 解:(1)加入过量铁粉后,铁离子和铜离子都与铁粉反应,反应的离子方程式为:2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu,
故答案为:2Fe3++Fe=3Fe2+;Cu2++Fe=Fe2++Cu;
(2)32g铜的物质的量为:$\frac{32g}{64g/mol}$=0.5mol,根据反应2Fe3++Cu=Cu2++2Fe2+可知,0.5mol铜完全反应消耗铁离子的物质的量为:0.5mol×2=1mol,则反应消耗的铁离子浓度为:$\frac{1mol}{1L}$=1mol/L,故腐蚀后残夜中铁离子浓度为:c(Fe3+)=3mol/L-1mol/=2mol/L;
腐蚀液中含有:n(Fe3+)=c(Fe3+)×1L=2mol、n(Cu2+)=0.5mol、n(Fe2+)=2n(Cu2+)=1mol,
加入过量铁粉后,根据反应2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu可知,溶滤液中含有亚铁离子的总物质的量为:n(Fe2+)=$\frac{3}{2}$n(Fe3+)+n(Cu2+)+n(Fe2+)=2mol×$\frac{3}{2}$+0.5mol+1mol=4.5mol,
根据质量守恒,通入氯气后新的腐蚀液中含有铁离子的物质的量为:n(Fe3+)=n(Fe2+)=4.5mol,
该滤液中铁离子浓度为:$\frac{4.5mol}{1L}$=4.5mol/L,
故答案为:2; 4.5.
点评 本题考查了离子反应的计算、离子方程式的书写,题目难度中等,注意掌握离子方程式的书写原则,明确物质的量浓度的概念及计算方法,(2)中计算新的腐蚀液中铁离子浓度为易错点,注意明确计算方法.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | Y在化合物中显+3价 | |
| B. | X与W只能形成一种化合物 | |
| C. | W的简单氢化物稳定性比Z的强 | |
| D. | X的最高价氧化物对应的水化物碱性比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液量碱性,只能与酸反应 | |
| B. | 乙与氧气的摩尔质量相同,则乙可能含极性键和非极性键 | |
| C. | 丙中含有第二周期IVA族元素,则丙一定是甲烷的同系物 | |
| D. | 丁和甲中各元素质量比相同,则丁中含有-2价的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①③⑥ | C. | ②④⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 △H=-116kJ•mol-1
△H=-116kJ•mol-1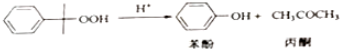 △H=-253k•mol-1
△H=-253k•mol-1
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丙烷和2-甲基丁烷互为同分异构体 | |
| B. | 沸点:正戊烷>正丁烷>2-甲基丙烷 | |
| C. | 分子式分别为C5H12、C9H20和C100H202的有机物一定互为同系物 | |
| D. | 含有5个碳原子的有机物分子中最多可形成4个C-C单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液能使蛋白质变性 | |
| B. | 糖类、油脂和蛋白质都属于高分子化合物 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 淀粉、油脂和蛋白质都能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com