
| A. | 单位时间内生成n mo1 O2的同时生成2n mol NO2 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的压强不再改变的状态 | |
| D. | 混合气体的密度不再改变的状态 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、单位时间内生成n mol O2的同时生成2n mol NO2,生成nmol氧气,会消耗2nmol二氧化氮,说明了正逆反应速率相等,达到了平衡状态,故A正确;
B、混合气体的颜色不再改变,说明二氧化氮的浓度不再变化,达到了平衡状态,故B正确;
C、混合气体的压强不再改变,说明气体的物质的量不变,达化学平衡状态,故C正确;
D、混合气体的密度不再改变的状态,由于反应两边都是气体,容器的体积不变,所以反应中密度始终不变,即密度不能作为判断化学平衡的依据,故D错误.
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
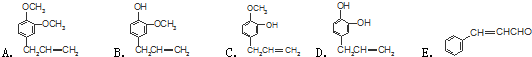
 $\stackrel{反应②}{→}$X,
$\stackrel{反应②}{→}$X,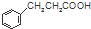 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | HCl | C. | H2SO4 | D. | KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
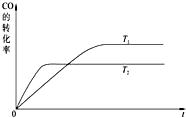 甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112mL | B. | 1008mL | C. | 224mL | D. | 448mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥⑧ | B. | ②③④⑦ | C. | ④⑤⑥⑧ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com