
【题目】除金、铂等极少数金属外,绝大多数金属元素以化合物形式存在于自然界中,将金属元素从其化合物中还原出来的工业工程称为金属的冶炼。下列材料描述了部分常见金属的冶炼方法。
①工业上冶炼镁的方法有两种,电解法和皮江法。电解法是电解熔融的氯化镁;皮江法是硅在高温下还原氧化镁。
②霍尔-埃鲁铝电解法是以氧化铝为原料、冰晶石(Na3AlF6)为熔剂组成的电解质,在950-970℃的条件下通过电解的方法使电解质熔体中的氧化铝分解为铝和氧气。
③冶炼锰一般用铝热法,即在高温下用铝还原二氧化锰。
④相关各物质熔点见下表:
物质 | Al2O3 | AlCl3 | MgO | MgCl2 | Al | Mn | Mg |
熔点/℃ | 2303 | 190 | 2800 | 712 | 660 | 1244 | 649 |
Ⅰ、根据上述信息回答下列问题:
(1)冶炼镁时电解熔融MgCl2而不电解熔融MgO,冶炼铝时电解熔融Al2O3而不电解熔融AlCl3的原因是______________________________________________。
(2)写出铝热法冶炼锰的化学方程式___________________________,
一般使用铝热法冶炼的金属具有哪些性质_____________________________。
(3)将铝和镁作电极分别插入稀硫酸、氢氧化钠溶液中,镁、铝分别作______极、_____极;写出介质是稀硫酸溶液时的正极电极反应式:______。
Ⅱ、下面是皮江法冶炼镁的工业流程示意图:

(1)气体a是_______。
(2)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有____________________________、_______________________。
(3)还原炉中抽空气到近似真空的原因是________________________________。
【答案】 MgO的熔点比MgCl2.更高,电解时需要更多的能量,故选用MgCl2;AlCl3属于共价化合物,熔融状态下不导电,故不能电解AlCl3 4Al+3MnO2![]() 2Al2O3+3Mn 熔点高且比铝不活泼的金属 正 负 2H+ +2e-=H2 CO2 2MgO+Si
2Al2O3+3Mn 熔点高且比铝不活泼的金属 正 负 2H+ +2e-=H2 CO2 2MgO+Si![]() 2Mg↑+SiO2 SiO2+CaO
2Mg↑+SiO2 SiO2+CaO![]() CaSiO3 【答题空10】防止已还原的Mg在高温条件下再次被氧化
CaSiO3 【答题空10】防止已还原的Mg在高温条件下再次被氧化
【解析】Ⅰ.(1)氧化镁熔点比氯化镁熔点高,熔融离子晶体要消耗能源,从而增加成本,为减少成本,所以用熔融氯化镁冶炼镁,氯化铝是共价化合物,熔融状态下不导电,以分子存在,所以冶炼铝用熔融氧化铝;(2)铝热法冶炼锰的化学方程式:4Al+3MnO2![]() 2Al2O3+3Mn,一般使用铝热法冶炼的金属具有的性质为:熔点高且比铝不活泼的金属;(3)将铝和镁作电极分别插入稀硫酸、氢氧化钠溶液中,由于铝能与氢氧化钠溶液反应,所以铝作负极、镁作正极;介质是稀硫酸溶液时由于镁的金属性强于铝,所以镁是负极,铝是正极,正极电极反应式为2H++2e-=H2↑。
2Al2O3+3Mn,一般使用铝热法冶炼的金属具有的性质为:熔点高且比铝不活泼的金属;(3)将铝和镁作电极分别插入稀硫酸、氢氧化钠溶液中,由于铝能与氢氧化钠溶液反应,所以铝作负极、镁作正极;介质是稀硫酸溶液时由于镁的金属性强于铝,所以镁是负极,铝是正极,正极电极反应式为2H++2e-=H2↑。
Ⅱ.(1)白云石煅烧分解生成氧化钙、氧化镁和二氧化碳,气体为二氧化碳;(2)还原炉需控制温度为1200℃左右,并抽空气到近似真空,还原炉中发生的主要反应有硅还原氧化镁生成镁和二氧化硅,二氧化硅和氧化钙形成炉渣硅酸钙,反应的化学方程式为:2MgO+Si![]() 2Mg↑+SiO2、SiO2+CaO
2Mg↑+SiO2、SiO2+CaO![]() CaSiO3;(3)还原炉中抽空气到近似真空的原因是防止已还原的Mg在高温条件下再次被氧化。
CaSiO3;(3)还原炉中抽空气到近似真空的原因是防止已还原的Mg在高温条件下再次被氧化。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
(1)恒温恒容下,在某密闭容器中充入CO(NH2)2和H2O,在120℃、催化剂作用下发生反应:CO(NH2)2 (s) + H2O(g)![]() 2 NH3(g)+CO2(g) △H >0。
2 NH3(g)+CO2(g) △H >0。
关于该反应的下列说法正确的是____。
A.混合气体的平均相对分子质量不再改变,可以作为化学平衡到达的标志
B.在平衡体系中充入He可使H2O的体积分数增大
C.降低温度使CO(NH2)2的转化率增大
D.达到平衡后,再充入少量CO(NH2)2, H2O的转化率不变
(2)一定条件下,某密闭容器中充入等物质的量的NH3和CO2,发生反应:CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g),混合气体中NH3的体积分数[φ(NH3)]随时间变化关系如图所示。
CO (NH2)2 (s) +H2O(g),混合气体中NH3的体积分数[φ(NH3)]随时间变化关系如图所示。

则a点的正反应速率V正(CO2)____ b点的逆反应速率V逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中进行反应A(s)+2B(g) ![]() C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )
C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )
①混合气体的密度不变 ②容器内气体的压强不变 ③混合气体的总物质的量不变 ④B的物质的量浓度不变 ⑤v正(C)=v逆(D) ⑥容器内物质A的质量 ⑦ v正(B)=v逆(C) ⑧n(B):n(C):n(D)=2:1:1
A. ①④⑤⑥ B. ②③⑥⑦⑧ C. ②④⑤⑥⑧ D. 只有④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂.工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
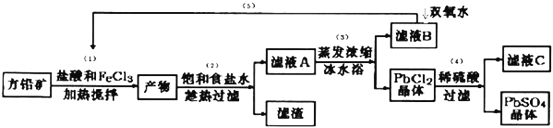
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7.
(I)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是 _____________________,反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为 ____________________________;
(II)步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是___________(请用平衡移动原理解释)
(III)上述流程中可循环利用的物质有___________;
(Ⅵ)步骤(4)中反应的离子方程式为_____________________.对滤液C中氯离子的测定可中和后采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。选用K2CrO4溶液的最好浓度等于 _____________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(Ⅴ)PbO2与MnO2性质相似,请写出PbO2与浓盐酸加热条件下反应的离子方程式______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5]有机化学基础:有机物丙(C13H18O2)是一种香料.其可由甲和乙在浓硫酸催化作用和加热条件下合成:
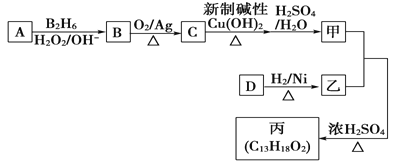
已知以下信息.:
①甲的相对分子质量为88,它的核磁共振氢谱显示有3组峰;
②乙为香醇的同系物.香醇的结构简式为: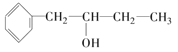
③![]()
回答下列问题:
(1)A的名称为____________。
(2)B的分子式为______________。
(3)C与新制碱性Cu(OH)2反应的化学方程式为____________。
(4)丙中有两个甲基.在一定条件下,1 mol D可以和2 mol H2反应生成乙.D可以发生银镜反应.则D 的结构简式为____________。
(5)甲与乙反应的化学方程式为______________,该反应类型为_________________:
(6)甲的同分异构体中含有“COO”结构的共有_____________种(不包含甲),其中核磁共振氢谱为3组 峰。且峰面积之比为6:1:1的为______________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 Na2 CO3和NaH CO3下列说法不正确的是( )
A.可以用加热的方法除去Na2 CO3中的NaH CO3
B.分别向Na2 CO3和NaH CO3溶液滴加少量盐酸,产生CO2气体较快的为NaH CO3
C.可以用Ca( OH)2 溶液区分Na2 CO3和NaH CO3溶液
D.Na2 CO3比NaH CO3易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 镀层破损后,白铁皮(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀
B. 埋在潮湿地下的铁管道比地上的铁管道更耐腐蚀
C. 钢铁发生析氢腐蚀时,正极上发生的电极反应式为:Fe-e-= Fe3+
D. 在钢铁表面涂上一层油漆,不能达到防止钢铁锈蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质能是一种洁净、可再生的能源。.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
⑴上述反应的催化剂含有Cu、Zn、AI等元素。写出基态Cu原子的核外电子排布式:___________。
⑵根据等电子原理.写出CO分子的电子式:______________。
(3)甲醇催化氧化可得到甲醛,甲醇的沸点比甲醛的高,其主要原因是___________________。
(4)胆矾结构示意图可简单表示如下,回答下列问题。

①胆矾晶体中存在的作用力有:__________________
②胆钒晶体溶于水呈蓝色,滴加少量氨水之后得到蓝色沉淀。再滴加氨水,沉淀又逐渐溶解。请写出蓝色沉淀溶解的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号:____________,某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是____________。
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+____________,BF3____________。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应方程式____________、_________。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为____________;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com