
| A. | CO | B. | NO | C. | CO2 | D. | N2 |
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)=c(HS-)=c(K+)>c(OH-)=c(H+) | |
| B. | c(Na+)>c(K+)>c(S2-)>c(H+)>c(OH-) | |
| C. | c(Na+)=c(S2-)+c(HS-)+c(H2S)+c(SO42-) | |
| D. | c(K+)+c(Na+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g氧气所含氧分子数为0.2NA | |
| B. | 1L0.1mol/L NaCl 溶液中所含的Na+为0.1NA | |
| C. | 0.012 kg 12C中含有碳原子数约为NA | |
| D. | 24g镁变成镁离子时失去的电子数为2N A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ②③④ | C. | ①③④⑥ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.5 | 90.0 |
| ② | ? | 0.5 | 2.5 | 36.0 |
| ③ | 碳粉质量的影响 | 0.2 | ? | 90.0 |
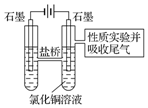
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+H2SO4═CO2↑+H2O+Na2SO4 | B. | CO2+2NaOH═Na2CO3+H2O | ||
| C. | CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$ 2MgO+C | D. | CO2+Na2O=Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com