
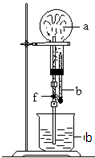
 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )| a(干燥气体) | b(液体) | |
| ① | N02 | 水 |
| ② | CO2 | 4mol•L-1NaOH溶液 |
| ③ | C12 | 饱和食盐水 |
| ④ | NH3 | l mol•L-1盐酸 |
| A. | ①和② | B. | ③和④ | C. | ①和③ | D. | ②和④ |
分析 要形成喷泉,必须满足则烧瓶内的气体应溶于溶液或与溶液发生反应,烧瓶内的气体体积减小,导致烧瓶内的压强小于大气压,据此解答.
解答 解:①二氧化氮与水反应生成不溶于水一氧化氮气体,导致烧瓶内的压强小于大气压形成喷泉实验,但是液体不能充满烧瓶,故①不选;
②二氧化碳和NaOH反应而导致烧瓶内的压强小于大气压,且反应后无气体剩余,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,故②选;
③氯气不溶于饱和食盐水,不能形成压强差,不能形成喷泉,故③不选;
④氨气与盐酸反应生成氯化铵,导致烧瓶内的压强小于大气压,且反应后无气体剩余,烧杯中的液体b呈喷泉状喷出,故④选;
故选:D.
点评 本题考查喷泉实验形成条件的探究,明确喷泉实验的原理是解题关键,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>R>Z>Y | |
| B. | 最高价氧化物对应水化物的酸性:R>Z>W | |
| C. | 对应单质的沸点:X>Z>Y | |
| D. | RY2、WY2通入BaCl2溶液中均无白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均减半 | B. | 均加半 | C. | 均增加1mol | D. | 均减少1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与NaOH溶液的反应:H++OH-═H2O | |
| B. | 铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与碘化钾溶液的反应:Cl2+I-═Cl-+I2 | |
| D. | 碳酸钠溶液与足量稀盐酸的反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钠的化合物在生产生活中应用广泛.
钠的化合物在生产生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | SO42-、SO32-至少含有一种 | |
| B. | 沉淀B的化学式为BaCO3 | |
| C. | 肯定存在的阴离子有CO32-、HCO3-、Cl-,还有SO42-、SO32-至少含有一种 | |
| D. | 肯定没有的离子是Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6与C4H10一定互为同系物 | |
| B. | C2H4与C4H8一定互为同系物 | |
| C. | 分子量相同的两种物质一定互为同分异构体 | |
| D. | 分子中含有羟基的物质一定是醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键 | B. | 共价化合物中不可能含有离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中不含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com