
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快。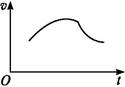
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率减慢的原因是 。
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:填空题
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(加热仪器和夹持装置已略去)。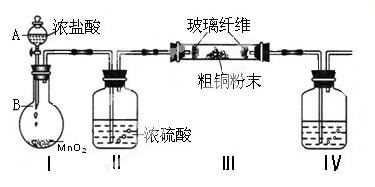
① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③如果浓盐酸不能顺利滴下,可能的原因是 。
④装置Ⅳ中盛装的试剂是 ,其作用是 。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
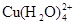 (aq) +4Cl-(aq)
(aq) +4Cl-(aq)
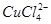 (aq) +4H2O(l)
(aq) +4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。
②现欲使溶液由黄色变成蓝色,请写出两种可采用的方法
a. b 。
(3)由CuCl2溶液得到CuCl2·2H2O的过程中要加入盐酸的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在密闭容器中进行的如下反应:2SO2(g)+O2(g) 2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
(1)反应的平衡常数为________。
(2)若将平衡时反应混合物的压强增大1倍,平衡将________(填“正向”“逆向”或“不”)移动。
(3)若平衡时反应混合物的压强减小1倍,平衡将________(填“正向”“逆向”或“不”)移动。
(4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,平衡将________(填“正向”“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D四个反应:
| 反应 | A | B | C | D |
| ΔH/(kJ·mol-1) | 10.5 | 1.80 | -126 | -11.7 |
| ΔS/(J·mol-1·K-1) | 30.0 | -113.0 | 84.0 | -105.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一恒温、恒容密闭容器中充入1mol CO2和3 mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。回答下列问题: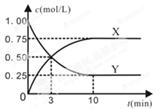
(1)Y的化学式是 。
(2)反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率v(H2)= mol·L-1·min-1。
(3)不能判断该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积比保持不变 | B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) | D.H2转化率为75% |
 CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| ⅰ | 150 | ½ | 0.1 |
| ⅱ | ________ | ________ | 5 |
| ⅲ | 350 | ________ | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
298 K时,合成氨反应:N2(g)+3H2(g) 2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ。原因是 _____________________________
2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ。原因是 _____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g) B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一固定容积的密闭容器中进行如下反应: 其平衡常数K和温度,的关系如下:
其平衡常数K和温度,的关系如下:
(1)该反应的平衡常数K的表达式为___________________。
(2)该反应的正反应为__________(填“吸热”“放热”)反应。
(3)能判断该反应是否已经达到化学平衡状态的是___________。
A. B.混合气体中CO浓度不变
B.混合气体中CO浓度不变
(4)在850℃时,可逆反应:
在该容器内各物质的浓度变化如下: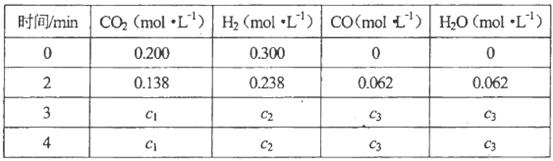
计算:3min~4min达到平衡时,CO的平衡浓度c3=________,CO2(g)的转化率a=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com