
| A. | 因为SO2有漂白性,所以它能使品红溶液、溴水褪色 | |
| B. | SO2和Cl2都有漂白作用,将两种气体同时作用于湿润的有色布条,漂白效果更好 | |
| C. | 在有些反应中显示氧化性,在有些反应中显示还原性 | |
| D. | 将SO2气体通入装有FeCl3溶液的试管里,黄色逐渐褪去 |
分析 A.依据二氧化硫漂白性、还原性解答;
B.SO2和Cl2等物质的量混合时,发生SO2+Cl2+2H2O═H2SO4+2HCl,生成物不具有漂白性;
C.依据二氧化硫中硫元素化合价判断;
D.依据二氧化硫具有还原性解答.
解答 解:A.二氧化硫使品红褪色体现其漂白性,二氧化硫使溴水褪色体现其还原性,故A错误;
B.SO2和Cl2等物质的量混合时,发生SO2+Cl2+2H2O═H2SO4+2HCl,生成物不具有漂白性,则不能使有色的物质褪色,故B错误;
C.二氧化硫中硫元素化合价为+4价,可以升高到+6价,可以降低到0,所以二氧化硫既具有氧化性又具有还原性,在有的反应中显示氧化性,有的反应中显示还原性,故C正确;
D.将SO2气体通入装有FeCl3溶液的试管里,发生氧化还原反应生成浅黄绿色的二价铁离子,故D错误;
故选:C.
点评 本题考查了二氧化硫的性质,明确二氧化硫的还原性、氧化性、酸性氧化物的性质是解题关键,注意物质氧化性判断方法:依据物质所含有元素化合价判断,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 化学反应的速率和限度均可通过改变化学反应条件而改变 | |
| C. | 可逆反应只是代表少数反应 | |
| D. | 化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 6:1 | C. | 1:5 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH、NH4HCO3都属于电解质 | |
| B. | 铝热剂、水玻璃、氨水均为混合物 | |
| C. | 铝、铁对应的氧化物均为碱性氧化物 | |
| D. | 溶液和胶体的本质区别是丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
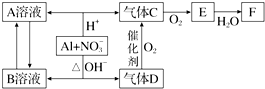
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煮沸后的溶液中没有加碱 | B. | 蔗糖尚未水解 | ||
| C. | 加热时间不够 | D. | 蔗糖水解的产物中没有葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com