
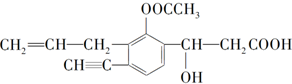
 某有机化合物结构简式为
某有机化合物结构简式为分析 根据有机物结构简式可确定有机物分子式,有机物含有碳碳双键、碳碳三键、酯基、羟基以及羧基,结合苯环的平面形结构特点解答该题.
解答 解:(1)有结构简式可知分子式为C16H16O5,故答案为:C16H16O5;
(2)有机物含有碳碳双键,碳碳三键、酯基、羟基以及羧基,故答案为:碳碳双键、碳碳叁键、羟基、酯基、羧基;
(3)由不同原子形成的共价键为极性键,含有C=O、C-O、C-H、O-H等,故答案为:C=O、C-O、C-H、O-H;
(4)与苯环直接相连的原子与苯环共平面,C≡C为直线形,则分子中一定与苯环处于同一平面的碳原子数有4个,分子中含有C=C、C=O两种双键,故答案为:4;2.
点评 本题考查有机物结构和性质,为高频考点,侧重于学生的分析能力的考查,明确官能团及性质的关系即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
.| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| A2D | 187 | 202 | 2.6 |
| A2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:
(1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨是人类科学技术上的一项重大突破,其反应原理为:
合成氨是人类科学技术上的一项重大突破,其反应原理为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 已知中和热为△H=-57.4 kJ•mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 | |
| D. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com