
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂. |
| D | 室温下其单质呈粉末固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等. |
分析 由题目信息可知,A为H,B为O,C为N,D为S,E为Fe.
(1)Fe位于第四周期第Ⅷ族;
(2)元素非金属越强,对应氢化物越稳定,H2O由于存在分子间氢键,熔沸点较H2S高;
(3)S与NaOH溶液该反应生成亚硫酸钠、硫化钠与水;
(4)C与A形成的原子个数比为1:2的化合物为N2H4,C与B形成的原子个数比为1:2的化合物为N2O4,N2H4与N2O4反应方程式生成氮气与水;
(5)根据质量比可得五种元素原子个数比为20:14:2:2:1,故此盐为(NH4)2SO4•FeSO4•6H2O,溶液中Fe2+与NH4+均水解,故溶液显酸性.
解答 解:由题目信息可知,A为H,B为O,C为N,D为S,E为Fe.
(1)Fe位于第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)非金属性O>S,故H2O和H2S中,H2O稳定性较强,H2O由于存在分子间氢键,所以熔沸点较H2S高,
故答案为:H2O;H2O;
(3)S与NaOH溶液该反应生成亚硫酸钠、硫化钠与水,反应离子方程式为:3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$SO32-+2S2-+3H2O,
故答案为:3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$SO32-+2S2-+3H2O;
(4)C与A形成的原子个数比为1:2的化合物为N2H4,C与B形成的原子个数比为1:2的化合物为N2O4,N2H4与N2O4反应生成氮气与水,反应方程式为:2N2H4+N2O4$\frac{\underline{\;点燃\;}}{\;}$3N2+4H2O,
故答案为:2N2H4+N2O4$\frac{\underline{\;点燃\;}}{\;}$3N2+4H2O;
(5)根据质量比可得H、O、N、S、Ee元素原子个数比为$\frac{5}{1}$:$\frac{56}{16}$:$\frac{7}{14}$:$\frac{16}{32}$:$\frac{14}{56}$=20:14:2:2:1,故此盐为(NH4)2SO4•FeSO4•6H2O,溶液中Fe2+与NH4+均水解:Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O+H+,故溶液显酸性,溶液中各离子浓度由大到小排列为:c(NH4+)>c(SO42-)>c(Fe2+)>c(H+)>c (OH-),
故答案为:<;Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O+H+;c(NH4+)>c(SO42-)>c(Fe2+)>c(H+)>c (OH-).
点评 本题考查结构性质位置关系应用,涉及元素化合物性质、元素周期律应用、常用化学用语、物质推断、盐类水解等,熟练掌握元素化合物性质,难度中等.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸馏、分液 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
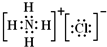 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 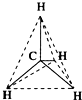 结构示意图 | B. |  电子式 | C. | 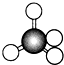 球棍模型 | D. |  比例模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于2 | B. | 在3~4之间 | C. | 等于3 | D. | 在2~3之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
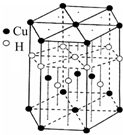 [Cu(NH3)4]SO4•H2O是一种杀虫剂.
[Cu(NH3)4]SO4•H2O是一种杀虫剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com