
小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究。
[实验一]探究浓硫酸的氧化性,将实验室常用的药品放入如图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
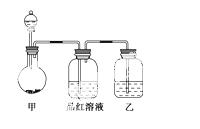
(1)该装置设计上存在明显缺陷,请指出:_______________________________。
(2)写出装置甲中反应的化学方程式:______________________________
__________________。装置乙中的试剂是:_______________________。
[实验二]探究某硫酸亚铁盐固体是否变质
(3)请你帮助小明同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
科目:高中化学 来源: 题型:
活性炭可用于处理大气污染物NO。在1 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当
温度分别在T1 ℃和T2 ℃时,测得平衡时各物质的物质的量如下表:
|
T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
(1)请结合上表数据,写出NO与活性炭反应的化学方程式:__________________。
(2)上述反应在T1 ℃时的平衡常数为K1,在T2 ℃时的平衡常数为K2。
①计算K1=__________________。
②根据上述信息判断,T1和T2的关系是__________。
a.T1>T2 b.T1<T2 c.无法比较
(3)在T1 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是________(填序号)。
a.增大c(NO) b.增大压强
c.升高温度 d.移去部分F
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组针对如何测定镀锌铁皮镀锌层厚度提出如下一些方案:
方案1.将一定质量的镀锌铁皮投入到足量的盐酸中,使其完全溶解,通过测量氢气的体积,计算铁皮上的锌的质量。
方案2.将一定质量的镀锌铁皮(W1)投入到足量的FeSO4溶液中,一段时间后,取出铁片,洗净、烘干、称量(W2),计算铁皮上的锌的质量。
方案3.将一定质量的镀锌铁皮投入到足量的盐酸中,使其完全溶解,再在所得溶液中加入过量的NaOH溶液,过滤、洗涤、烘干、灼烧、沉淀,最后称量。
……
(1)方案2的主要特点是__________,
方案3的主要缺点是__________。
(2)方案1中用到测量气体体积的装置,如图装置中不能用于测量气体体积的装置是 。
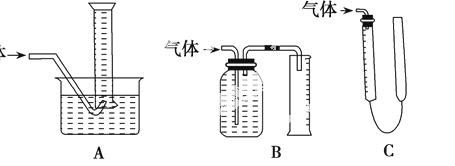
学习小组拟选用C装置作量气装置,则气体收集完毕,准备读数时,应注意:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
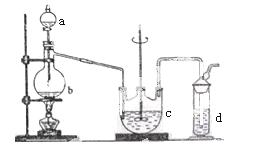
(1)b中反应的离子方程式为__________________,c中试剂为_______________ ______。
______。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________________。
(3)d中的试剂为____________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某品牌消毒液包装说明的部分内容摘录如下:主要有效成分为次氯酸钠,有效氯含量8000 mg/L~10000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用,切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉处保存。请完成以下实验探究过程:
(一)阅读材料,获取信息
(1)推测该消毒液的酸碱性:________,原因是(用离子方程式表示)________。
(2)该消毒液还具有的化学性质是________性和________性。
(3)从该消毒液的保存要求分析,导致其失效的外界因素主要是________。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
(三)实验探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯中浸泡一段时间,对可能产生的现象有如下假设:假设①:有明显现象;假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是________。
(5)基于假设②,结论是________,请设计实验进一步验证该结论,叙述实验操作:
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上研究燃料脱硫的过程中,涉及如下反应:
 CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)

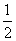 CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g) 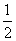 CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
 (1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:

前100 s 内v(SO2)= mo1·L-1·s-l,平衡时CO的转化率为 。
(3)若只研究反应II,在不同条件下其反应能量变化如下图所示:图中曲线a到曲线b的措施是________,恒温恒容时,下列说法能说明反应Ⅱ到达平衡状态的是____ 。
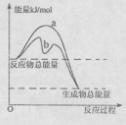
A.体系中气体的平均摩尔质量不再改变
B.v(CO)=v(CO2)
C.CO的转化率达到了最大限度
D.体系内气体压强不再发生变化
(4)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量[用n(CO)表示]对CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
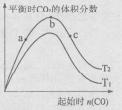
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是____ 。
②图像中T2 T1(填“高于”、“低于”、“等于”或“无法确定”):判断的理由是____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是关于反应A2(g)+3B2(g)  2C(g)(正反应为放热反应)
2C(g)(正反应为放热反应)
的平衡移动图形,影响平衡移动的原因是
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时使用适宜的催化剂
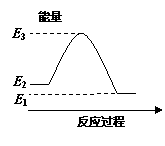 D.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时减小生成物浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列说法中正确的是
A.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子
B.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
C.0.1mol金属钠在过量氧气中充分燃烧,生成的化合物中离子总数为0.15NA
D.在VLCO和NO的混合气体中含有的氧原子个数为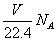
查看答案和解析>>
科目:高中化学 来源: 题型:
一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量的饱和石灰水完全吸收可得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量是( )
A.0.5Q B. Q C. 2Q D.5Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com