
| A�� | ������ѹ������������������ƽ����Է����������� | |
| B�� | �ټ���һ������������泥�ƽ�������ƶ� | |
| C�� | CO2���������������÷�Ӧ�ﵽƽ��״̬ | |
| D�� | 25��ʱ��������淋ķֽ�ƽ�ⳣ��Ϊ2.048��10-9mol3•L-3 |
���� A����������а�����������̼���ʵ���֮��Ϊ��ֵ2��1��
B������������ʵ���������Ӱ��ƽ���ƶ���
C����������а�����������̼���ʵ���֮��Ϊ��ֵ2��1���Է�Ӧ��ʼ������̼������������䣻
D����������а�����������̼���ʵ���֮��Ϊ2��1�������Ũ�ȼ������Ũ�ȣ�ƽ�ⳣ��K=c2��NH3����c��CO2����
��� �⣺A��������ѹ�������ѹǿ����ƽ����Ȼ���淴Ӧ�ƶ�������������а�����������̼���ʵ���֮��Ϊ��ֵ2��1�������������ƽ����Է����������䣬��A����
B������������ʵ���������Ӱ��ƽ���ƶ�����B����
C����������а�����������̼���ʵ���֮��Ϊ��ֵ2��1���Է�Ӧ��ʼ������̼������������䣬��C����
D����������а�����������̼���ʵ���֮��Ϊ2��1��ƽ��������Ũ��Ϊ2.4��10-3mol•L-1����c��NH3��=1.6��10-3mol•L-1��c��CO2��=0.8��10-3mol•L-1����ƽ�ⳣ��K=c2��NH3����c��CO2��=2.048��10-9mol3•L-3����D��ȷ��
��ѡ��D��
���� ���⿼�黯ѧƽ�������Ӱ�����أ�Cѡ��Ϊ�״��㣬ѧ�����������������̼�����ʵ���Ϊ���ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
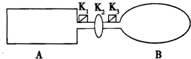 ��ͼװ���У�A���ɵ��Ȳ����Ƴɵ��ܱ�������B���ͻ�ѧ��ʴ�����ڴ��ȵ������ر�K2����������1molNO2ͨ��K1��K3�ֱ��A��B�У���Ӧ��ʼʱ��A��B�������ͬ��Ϊa L����֪��2NO2��g��?N2O4��g����H��0
��ͼװ���У�A���ɵ��Ȳ����Ƴɵ��ܱ�������B���ͻ�ѧ��ʴ�����ڴ��ȵ������ر�K2����������1molNO2ͨ��K1��K3�ֱ��A��B�У���Ӧ��ʼʱ��A��B�������ͬ��Ϊa L����֪��2NO2��g��?N2O4��g����H��0�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 80% | B�� | 65% | C�� | 45% | D�� | 37% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������绯ѧ��ʴʱ�����������ķ�Ӧ�ǣ�Fe-3e-�TFe3+ | |
| B�� | ���������Դ�������������ɷ�ֹ��������ʴ | |
| C�� | �ڶƼ��϶�ͭʱ��ͭ������ | |
| D�� | ������ʴ�У�������ʴ�����ⸯʴ���ձ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ʵ��С������ͼ��ʾ��ʵ��װ�ý���ʵ�飮
ʵ��С������ͼ��ʾ��ʵ��װ�ý���ʵ�飮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com